The National Institute on Alcohol Abuse and Alcoholism maintains a database of alcohol-related health effects. [81]
| BAC (mg/dL) | Symptoms[82] |
|---|---|
| 50 | Euphoria, talkativeness, relaxation |
| 100 | Central nervous system depression, impaired motor and sensory function, impaired cognition |
| >140 | Decreased blood flow to brain |
| 300 | Stupefaction, possible unconsciousness |
| 400 | Possible death |
| >550 | Death |
Ethanol is a central nervous system depressant and has significant psychoactive effects in sublethal doses; for specifics, see effects of alcohol on the body by dose. Based on its abilities to change the human consciousness, ethanol is considered a drug.[83] Death from ethyl alcohol consumption is possible when blood alcohol level reaches 0.4%. A blood level of 0.5% or more is commonly fatal. Levels of even less than 0.1% can cause intoxication, with unconsciousness often occurring at 0.3–0.4%.[84]
The amount of ethanol in the body is typically quantified by blood alcohol content (BAC), the milligrams of ethanol per 100 milliliters of blood. The table at right summarizes the symptoms of ethanol consumption. Small doses of ethanol generally produce euphoria and relaxation; people experiencing these symptoms tend to become talkative and less inhibited, and may exhibit poor judgment. At higher dosages (BAC > 100 mg/dl), ethanol acts as a central nervous system depressant, producing at progressively higher dosages, impaired sensory and motor function, slowed cognition, stupefaction, unconsciousness, and possible death.
In America, about half of the deaths in car accidents occur in alcohol-related crashes.[85] There is no completely-safe level of alcohol for driving; the risk of a fatal car accident rises with the level of alcohol in the driver"s blood.[86] However, most drunk driving laws governing the acceptable levels in the blood while driving or operating heavy machinery set typical upper limits of blood alcohol content (BAC) between 0.05% to 0.08%.
Ethanol within the human body is converted into acetaldehyde by alcohol dehydrogenase and then into acetic acid by acetaldehyde dehydrogenase. The product of the first step of this breakdown, acetaldehyde,[87] is more toxic than ethanol. Acetaldehyde is linked to most of the clinical effects of alcohol. It has been shown to increase the risk of developing cirrhosis of the liver,[77] multiple forms of cancer, and alcoholism.
Ethanol can intesify the sedation caused by other central nervous system depressant drugs such as barbiturates, benzodiazepines, opioids, and phenothiazines[84]
Some individuals have less-effective forms of one or both of the metabolizing enzymes, and can experience more-severe symptoms from ethanol consumption than others. Conversely, those who have acquired alcohol tolerance have a greater quantity of these enzymes, and metabolize ethanol more rapidly.[88]
Ethanol is classified as a teratogen. See fetal alcohol syndrome.
Frequent drinking of alcoholic beverages has been shown to be a major contributing factor in cases of elevated blood levels of triglycerides.[89]
Ethanol is not a carcinogen.[90][91] However, the first metabolic product of ethanol, acetaldehyde, is toxic, mutagenic, and carcinogenic. Also, ethanol"s effect on the liver can contribute to immune suppression. Consequently, consumption of alcoholic beverages can be an aggravating factor in carcinogenesis.
Organometallic compounds are also known as organo-inorganics, metallo-organics and metalorganics. Organometallic compounds are distinguished by the prefix "organo-" e.g. organopalladium compounds. Examples of such organometallic compounds include all Gilman which contain lithium and copper. Tetracarbonyl nickel, and ferrocene are examples of organometallic compounds containing transition metals. Other examples include organomagnesium compounds like iodo(methyl)magnesium MeMgI, diethylmagnesium (Et2Mg), and all Grignard reagents; organolithium compounds such as butyllithium (BuLi), organozinc compounds such as chloro(ethoxycarbonylmethyl)zinc (ClZnCH2C(=O)OEt); and organocopper compounds such as lithium dimethylcuprate (Li+[CuMe2]–).
In addition to the traditional metals, lanthanides, actinides, and semimetals, elements such as boron, silicon, arsenic, and selenium are considered to form organometallic compounds, e.g. organoborane compounds such as triethylborane (Et3B).
Many complexes feature coordination bonds between a metal and organic ligands. The organic ligands often bind the metal through a heteroatom such as oxygen or nitrogen, in which case such compounds are considered coordination compounds. However, if any of the ligands form a direct M-C bond, then complex is usually considered to be organometallic, e.g., [(C6H6)Ru(H2O)3]2+. Furthermore, many lipophilic compounds such as metal acetylacetonates and metal alkoxides are called "metalorganics."
Many organic coordination compounds occur naturally. For example, hemoglobin and myoglobin contain an iron center coordinated to the nitrogen atoms of a porphyrin ring; magnesium is the center of a chlorin ring in chlorophyll. The field of such inorganic compounds is known as bioinorganic chemistry. In contrast to these coordination compounds, methylcobalamin (a form of Vitamin B12), with a cobalt-methyl bond, is a true organometallic complex, one of the few known in biology. This subset of complexes are often discussed within the subfield of bioorganometallic chemistry. Illustrative of the many functions of the B12-dependent enzymes, the MTR enzyme catalyzes the transfer of a methyl group from a nitrogen on N5-methyl-tetrahydrofolate to the sulfur of homocysteine to produce methionine.
The status of compounds in which the canonical anion has a delocalized structure in which the negative charge is shared with an atom more electronegative than carbon, as in enolates, may vary with the nature of the anionic moiety, the metal ion, and possibly the medium; in the absence of direct structural evidence for a carbon–metal bond, such compounds are not considered to be organometallic.
Depending mostly on the nature of metallic ion and somewhat on the nature of the organic compound, the character of the bond may either be ionic or covalent. Organic compounds bonded to sodium or potassium are primarily ionic. Those bonded to lead, tin, mercury, etc. are considered to have covalent bonds, and those bonded to magnesium or lithium have bonds with intermediate properties.
Organometallic compounds with bonds that have characters in between ionic and covalent are very important in industry, as they are both relatively stable in solutions and relatively ionic to undergo reactions. Two important classes are organolithium and Grignard reagents. In certain organometallic compounds such as ferrocene or dibenzenechromium, the pi orbitals of the organic moiety ligate the metal.
Organometallics find practical uses as stoichiometric and catalytically active compounds. Tetraethyl lead previously was combined with gasoline as an antiknock agent. Due to lead"s toxicity it is no longer used, its replacements being other organometallic compounds such as ferrocene and methylcyclopentadienyl manganese tricarbonyl (MMT). The Monsanto process utilizes a rhodium-carbonyl complex to manufacture acetic acid from methanol and carbon monoxide industrially. Similarly, the Wacker process is used in the oxidation of Olefins. The Ziegler-Natta catalyst is a titanium-based organometallic compound used in the production of polyethylene and other polymers.
Ryoji Noyori"s chiral ruthenium-BINAP complex catalytically reduces beta-ketoesters to secondary alcohols in the production of fine chemicals and pharmaceuticals. Another common industrial organometallic compound is the Grubbs catalyst, a carbenoid (an organometallic compound of a carbene and a metal).
Organometallic compounds of the reactive metals such as lithium or zinc are extremely basic and may also act as reductants. These superbases are used in organic syntheses. Butyllithium is an example, widely used in synthetic organic chemistry. They are air-sensitive, however, and their flammability severely limits their industrial use.
Electron counting is key in understanding organometallic chemistry. The 18-electron rule is helpful in predicting the stabilities of organometallic compounds. Organometallic compounds which have 18 electrons (filled s, p, and penultimate d orbitals) are relatively stable. This suggests the compound is isolable, but it can result in the compound being inert.
To understand chemical bonding and reactivity in organometallic compounds the isolobal principle should be used. NMR and infrared spectroscopy are common techniques used to determine structure and bonding in this field. Scientists are allowed to probe fluxional behaviors of compounds with variable-temperature NMR.
Organometallic compounds undergo several important reactions:
شیمی آلی فلزی شیمی ترکیب هایی است که دارای پیوند کربن فلز می باشند، این زمینه از شیمی انواع گوناگونی از ترکیبات را در بر می گیرد .این ترکیب ها عبارتند از ترکیب هایی که هم دارای پیوند (?) و هم دارای پیوند (?) بین اتم های فلز و کربن می باشند. تعداد زیادی ترکیب ها ی خوشه ای ، حاوی یک یا چند پیوند فلز- فلز را شامل می شوند . همچنین شامل مولکولهایی می شوند که ساختار غیر معمول یا ناشناخته در شیمی آلی دارند و واکنش هایی را در بر می گیرند که در بعضی موردها مشابه واکنش های شناخته شده در شیمی آلی اند . در برخی موردها ، کاملا با آن تفاوت دارند. ترکیب های آلی فلزی افزون بر خواص جالب توجه ، کاتالیزگرهایی را نیز می سازند که از نظر صنعتی بسیار مفیدند . در سالهای اخیر واکنشگر های آلی فلزی در سنتز تعداد زیادی از مولکولها ، نقش کلیدی و اساسی پیدا کرده اند . همچنین این ترکیب ها ، مولکولهایی را شامل می شوند که تعداد زیادی از آن ها دارای فعالیت های بیولوژیکی اند.
ترکیبات آلی فلزی را ممکن است صرفا به عنوان ترکیباتی که شیمی آلی فلزات را تشکیل میدهند، مشخص کرد. با وجود این ، مرزبندی بین ترکیبات آلی فلزی و شیمی آلی فلزی واضح و روشن نیست. هر شیمیدانی ، نیکل تترا کربونیل 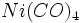 را بهعنوان یک ترکیب آلی فلزی شناسایی و مشخص میکند. با وجود این به سختی میتوان منوکسید کربن را نوعا یک ترکیب آلی قلمداد کرد. به همین ترتیب ، ترکیبات آلی فسفر ، آلی گوگرد و آلی سلنیوم در مرز شیمی آلی فلزی قرار میگیرند، با این که فسفر ، گوگرد و سلنیوم جزء غیرفلزات مرزی هستند.
را بهعنوان یک ترکیب آلی فلزی شناسایی و مشخص میکند. با وجود این به سختی میتوان منوکسید کربن را نوعا یک ترکیب آلی قلمداد کرد. به همین ترتیب ، ترکیبات آلی فسفر ، آلی گوگرد و آلی سلنیوم در مرز شیمی آلی فلزی قرار میگیرند، با این که فسفر ، گوگرد و سلنیوم جزء غیرفلزات مرزی هستند.
شیمی آلی فلزی مهم و ادراک بهتری از پیوند ، ساختار و واکنش پذیری مولکولها بدست میدهد که پارهای از آنها منحصر به شیمی آلی فلزی است. از نظر عملی ، کاتالیزورهای آلی فلزی در عصری که لازم است در فرآیندهای شیمیایی دما و در نتیجه سوخت را به حداقل برسانیم، بطور فزایندهای اهمیت پیدا میکند.
در زمان ورنر ، نظریه والانس آن قدر پیشرفت نکرده بود که وی بتواند درباره ماهیت پیوند در ترکیباتی که مطالعه میکرد، خیلی اظهار نظر کند. با این حال ، کوشش وی در تمییز بین گروههای یونش پذیر و یونش ناپذیر (مثلا 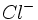 ) راه را برای پیدایش تشکیل پیوند براساس پیوند یونی در مقابل پیوند کووالانسی باز کرد. نخستین کوشش در زمینه توجیه پیوند در کمپلکسها توسط سیجویک به عمل آمد. وی نظریه هشت تایی لوویس را به ترکیبات کئوردینانس تعمیم داد.
) راه را برای پیدایش تشکیل پیوند براساس پیوند یونی در مقابل پیوند کووالانسی باز کرد. نخستین کوشش در زمینه توجیه پیوند در کمپلکسها توسط سیجویک به عمل آمد. وی نظریه هشت تایی لوویس را به ترکیبات کئوردینانس تعمیم داد.
او چنین در نظر گرفت که لیگاندها باز لوییساند و به یون فلز که به صورت اسید لوییس عمل میکند، الکترون (معمولا به ازای هر لیگاند یک زوج الکترون) نمیدهند. فرض شد که پایداری این ترکیبات به آرایش الکترونی گاز نجیب وابسته باشد. مجموع الکترونهای فلز به اضافه الکترونهای داده شده بوسیله لیگاندها ، عدد اتمی موثر (EAN) نامیده شد و وقتی این عدد Kr)36 ، (Xe)54) یا Rn)86) بود، گفته میشد که از قاعده EAN تبعیت شده است. به بیان دیگر ، میتوان گفت که وقتی آرایش الکترونی به صورت 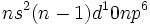 است، 18 الکترون در این اوربیتالهای والانس حضور دارند که یک آرایش الکترونی بسته را تشکیل می دهند.
است، 18 الکترون در این اوربیتالهای والانس حضور دارند که یک آرایش الکترونی بسته را تشکیل می دهند.
در واقع از این قاعده تقریبی بیش از پیش به عنوان قاعده 18 الکترون یاد می شود و مزیت آن این است که برای ردیفهای جدول تناوبی یکسان است و الزامی ندارد که برای هر گاز نجیب به EAN متفاوتی اشاره کنیم. علاوه بر این ، به خاطر سپردن این عدد آسان است، چون صرفا به ظرفیت 9 اوربیتال ، مجموعه ای از یک اوربیتال S ، سه اوربیتال P و پنج اوربیتال d تشکیل می شود، اشاره دارد.
تعداد ترکیبات آلی فلزی بخصوص کربونیلها و نیتروزیلهای فلزی که از این قاعده تبعیت میکنند، نسبتا زیاد است و زمانی بکار میآید که برای عضوی از این گروههای ترکیبات آلی فلزی که از آن تبعیت میکنند، بکار برده شود.
چیزی که مانع بررسی کمی اوربیتالهای مولکولی در کربونیلها میشود، نداشتن معلومات در مورد انرژیهای نسبی اوربیتالهای گوناگون میباشد. با وجود این ، میتوانیم ملاحظه کنیم که در تمام کمپلکسهای کربونیل و تا حد کمتری در سایر ترکیبات آلی فلزی سیستم ( پیوندی سیگما ) قوی که توسط اثر بده و بستانی سیستم ( پیوندی پی ) تقویت شده است، منجر به جدایی شدید اوربیتالهای پیوندی و ضد پیوندی میشود. در این صورت فقط یک آرایش با پایداری ماکسیمم وجود دارد که آن هم معمولا مربوط به یک مجموعه هجده الکترونی است.
تقریبا کلیه فلزات واسطه ، ترکیباتی میدهند که آنها کربن منوکسید بهصورت لیگاند عمل میکند. در مورد این ترکیبات سه نکته قابل توجه است:
 |
 |
 |
 |
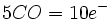 |
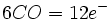 |
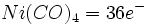 |
 |
 |
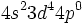 نوشت و وقتی به این شش الکترون ، شش زوج الکترون که بوسیله گروههای کربن منوکسید تامین میشوند، اضافه گردد جمعا 18 الکترون (6+12=18) خواهیم داشت. پس تنها با شمارش الکترونها در اوربیتالهای 3d ، 4s و 4p داریم:
نوشت و وقتی به این شش الکترون ، شش زوج الکترون که بوسیله گروههای کربن منوکسید تامین میشوند، اضافه گردد جمعا 18 الکترون (6+12=18) خواهیم داشت. پس تنها با شمارش الکترونها در اوربیتالهای 3d ، 4s و 4p داریم: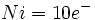 |
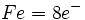 |
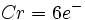 |
 |
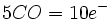 |
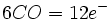 |
 |
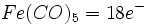 |
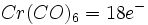 |
در فلزاتی که عدد اتمی آنها فرد است، قاعده 18 الکترون صرفا بوسیله افزایش لیگاندهای کربن منوکسید برآورده نمیشود؛ زیرا تعداد الکترونهای جزء حاصل ، صرفنظر از اینکه چه تعداد کربونیل اضافه شده باشد، فرد خواهد بود ( و بنابراین تعداد الکترونها مساوی 18 نمیشود ). در این فلزات قاعده 18 الکترون به چند طریق برآورده میشود. سادهترین آنها افزودن یک الکترون بوسیله عامل کاهنده است که یک آنیون مثل 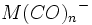 تشکیل میدهد. بطریق دیگر ، آن جزء که دارای کمبود الکترون است می تواند بطور کوالانسی با اتم یا گروهی مثل هیدروژن یا کلر که آن نیز یک الکترون جفت نشده دارد، تشکیل پیوند بدهد:
تشکیل میدهد. بطریق دیگر ، آن جزء که دارای کمبود الکترون است می تواند بطور کوالانسی با اتم یا گروهی مثل هیدروژن یا کلر که آن نیز یک الکترون جفت نشده دارد، تشکیل پیوند بدهد: 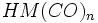 یا
یا 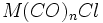 . سرانجام چنانچه گونه دیگری موجود نباشد که جزء فلز کربونیل با آن ترکیب شود، دو جزء فلز کربونیل هر کدام با یک الکترون فرد میتوانند از طریق به اشتراک گذاشتن این الکترونها بهصورت دیمر در آیند.
. سرانجام چنانچه گونه دیگری موجود نباشد که جزء فلز کربونیل با آن ترکیب شود، دو جزء فلز کربونیل هر کدام با یک الکترون فرد میتوانند از طریق به اشتراک گذاشتن این الکترونها بهصورت دیمر در آیند.
دانههای برف ، نمونههایی در این مورد هستند، با شکلهای پیچیده ای که معمولا شش گوشهای تقریبا مسطح است. خطی که عمود بر صفحه دانه برف از مرکز آن گذشته ، دربرگیرنده یک محور درجه دو (C2) ، یک محور درجه سه (C3) و یک محور درجه شش (C6) است. دقت کنید که چرخش به اندازه ?240 (C23) و ?300 (C56) نیز جزو اعمال تقارن دانه برف میباشند.
همچنین دو مجموعه سهتایی دیگر از محورهای C2 در صفحه دانه برف وجود دارد که یک مجموعه از نقطههای متقابل و مجموعه دیگر از وسط اضلاع میان نقطهها میگذرد. در مولکولهای دارای بیش از یک محور چرخشی ، محور Cn دارای بزرگترین مقدار n ممکن بهعنوان محور چرخش با بزرگترین مرتبه یا محور اصلی تعیین میشود.
محور چرخش با بزرگترین مرتبه در دانه برف ، محور C6 است. (در موقع انتقال به مشخصات کارتزین ، محور Cn با بزرگترین مرتبه معمولا بهعنوان محور Z انتخاب میشود). در صورت لزوم ، محورها C2 عمود بر محور اصلی را با پریم مشخص میکنند. یک تک پریم نشان میدهد که محور از داخل چندین اتم مولکول میگذرد، در حالیکه یک جفت پریم نشان میدهد که محور از بین اتمها میگذرد.
عمل وارونگی (i)
این عمل ، کمی پیچیدهتر است. هر نقطه از وسط مرکز مولکول به موقعیتی مقابل موقعیت اولیه حرکت میکند، بهطوریکه فاصله اش از نقطه مرکزی برابر با فاصله ای باشد که در آغاز داشت. اتان در حالت صورتبندی نامتقابل نمونه ای از مولکولهایی است که دارای مرکز وارونگی میباشند. بسیاری از مولکولها که در نگاه اول به نظر میرسد مرکز وارونگی دارند، فاقد آن هستند. متان و مولکولهای چهار وجهی دیگر ، نمونههایی از این مولکولها هستند.
اگر دو اتم هیدروژن یک مدل متان در صفحه عمودی سمت راست و دو اتم هیدروژن دیگرش در صفحه افقی در چپ نگاه داشته شود، عمل وارونگی دو هیدروژن واقع در صفحه افقی را به سمت راست و دو هیدروژن واقع در صفحه عمودی را به سمت چپ منتقل میکند. پس متان ، عمل وارونگی ندارد، چون جهتگیری مولکول پس از عمل i با جهتگیری اولیه متفاوت است.
بطور کلی ، چهار وجهیها ، مسطح مثلثیها ، پنج ضلعیها مرکز وارونگی ندارند. مربعها ، متوازیالاضلاعها ، اجسام راستگوشه و دانههای برف مرکز وارونگی دارند.
این عمل که گاهی اوقات ، چرخش نامتقارن نامیده میشود، مستلزم چرخش به اندازه 360 بر n درجه و به دنبال آن ، انعکاس از صفحه عمود بر محور چرخش میباشد. برای مثال ، در متان ، خطی که از وسط کربن عبور کرده و زاویه میان هیدروژنها را در طرفین نصف میکند، یک محور S4 میباشد. از این نوع خط سه تا و در کل سه محور S4 وجود دارد. این عمل ، مستلزم چرخش مولکول به اندازه ?90 و سپس انعکاس از صفحه آینهای عمود میباشد. دو عمل متوالی Sn یک محور Cn/2 ایجاد میکند. در متان ، دو عمل S4 یک C2 ایجاد میکند.
بعضی وقتها ممکن است محور Sn مولکول با محور Cn آن منطبق باشد. مثلا دانههای برف ، علاوه بر محورهای چرخش اشاره شده در بالا ، محورهای S2 ، S3 و S6 منطبق بر محور C6 نیز دارند. دقت کنید که محور S2 با وارونگی و محور S1 با صفحه آینهای یکسانی هستند. در مورد اول ، نماد i و در مورد دوم نماد ? ترجیح داده میشود.
تعدادی سایت و وبلاگ
به زبان فارسی که از نظر آموزشی بسیار مفید میباشند را در اینجا معرفی میکنم
*********پرتال بیوانفورماتیک
ایرانیان***********
دارای چندین کتاب
الکترونیکی رایگان ،مقاله ،کاملترین لینک باکس پایگاههای بیوانفورماتیکی و غیره
http://www.ibp.ir
*********** پایگاه آموزش
الکترونیکی علوم زیستی
*************
دارای چهار بخش اصلی شامل
انجمنهای گفتمان علوم زیستی
کتابخانه الکترونیکی علوم زیستی
فروشگاه الکترونیکی علوم زیستی
بخش آموزش الکترونیک علوم زیستی
http://www.ibpel.com
*********** وبلاگ برنامه نویسی
بیوانفورماتیک *************
این وبلاگ
به تازگی راه اندازی شده است و سعی دارد در رابطه با زبانهای برنامه نویسی
بیوانفورماتیک به ارائه مطلب بپردازد
http://www.ibpg.blogfa.com
*********** وبلاگ سیستم بیولوژی *************
در این
وبلاگ در رابطه با علم نوین سیستم بیولوژی به ارائه مطلب پرداخته میشود
http://irsbn.blogfa.com
*********** وبلاگ شیمی انفورماتیک *************
در این
وبلاگ در رابطه با علم نوین شیمی انفورماتیک مطالبی ارائه میشود همین وبلاگی که در حال حاظر در آن قرار دارید
http://cheminformatics.mihanblog.com
*********** وبلاگ بیوانفورماتیک *************
وبلاگ
بیوانفورماتیک حدود سه سال هست که این وبلاگ در زمینه بیوانفورماتیک به ارائه مطلب میپردازد
http://bioinformatics.mihanblog.com
با آرزوی
موفقیت برای شما دوست عزیز
از قیدوبند رها شده و شروع به جنبش و حرکت میکنند، درنتیجه زود گرم میشود. چنین مادهای دارای ظرفیت گرمایی اندکی است. اما هنگامی که ذرات و اتمهای یک ماده با پیوندهای قوی به هم متصل شده باشند، با دادن اندک انرژی یا گرما به آن، ذرات از قید و بند رها نشده و شروع به حرکت نمیکنند. در چنین جسمی برای رهاندن ذرات از قیدوبند جاذبهی بین ذرات، نیاز به دادن گرمای بیشتری است و درنتیجه ظرفیت گرمایی این ماده بالا میرود. بنابراین همواره انتظار می رود که ظرفیت گرمایی مربوط به حالت جامد هر ماده از حالت مایع آن بیشتر باشد چون جاذبه ی بین ذرات در حالت جامد بیشتر از حالت مایع است. و نیز ظرفیت گرمایی حالت مایع هر ماده از حالت گاز بیشتر باشد چون در حالت گاز تقریبا؛ جاذبه ی بین ذرات صفر است و با گرفتن اندک انرژی انرژی جنبشی و درنتیجه دمای آنها افزایش می یابد. به عنوان مثال ظرفیت گرمایی ویژه کلروفورم CHCl3 در حالت گازی برابر 81/65 و در حالت مایع برابر 3/116 با واحد j/mol.K می باشد. غیر از نوع و ذات اتمهای موجود در یک ماده ، حالت ماده نیز در تعیین ظرفیت گرمایی مهم است، زیرا در حالتهای مختلف از یک جسم، پیوندهای بین ذرات آن هم متفاوت میشود. اما در آب یک حالت استثنا وجود دارد و آب نه در حالت مایع بلکه در حالت جامد بیشترین و محکم ترین ژیوندها در بین مولکولهای ان قرار دارد و درنتیجه برای گسستن آنها انرژی زیادی لازم داریم و درنتیجه ظرفیت گرمایی آب در حالت مایع از همه بیشتر است.در آب، مولکولها به وسیلهی پیوندهای قوی هیدروژنی به یکدیگر متصل هستند. در چنین شرایطی برای سست کردن یا پاره کردن این پیوندها و به حرکت درآوردن مولکولها و سرانجام افزایش دمای آب، نیاز به دادن انرژی و گرمای زیادی داریم و درنتیجه ظرفیت گرمایی آب زیاد میباشد. اما در یخ، آرایش مولکولها به نحو دیگری است، مولکولهای آب به صورت ششضلعیهایی کنار هم قرار میگیرند طوریکه یک فضای خالی بین این ششضلعیها به وجود میآید. درضمن هنگام تبدیل آب به یخ یک سری ژیوندهای هیدروزنی شکسته می شوند تا بتواند آرایش جدید را به خود بگیرد. حال انرژی اندکی برای تخریب این ساختمان مورد نیاز است، درنتیجه ظرفیت گرمایی یخ کمتر از ظرفیت گرمایی آب میباشد.
همچنین ظرفیت گرمایی بخار آب نیز با تعمیم رابطه ی بالا نیز نسبت به آب اندک است، زیرا بین مولولها در حالت بخار، هیچ جاذبه ای و قید و بندی وجود ندارد، درنتیجه به راحتی می توان جنبش آنها را کم یا زیاد نمود، بنابراین ظرفیت گرمایی بخار نیز اندک است.با این توضیحات می توان نتیجه گرفت که این موضوع(تغییر ظرفیت گرمایی با تغییر حالت ماده) در مورد تمام مواد صدق می کند.
1.شیمی 3 و آزمایشگاه
2.انجمن شیمی دانان اصفهان
3.کلاس شیمی...
4.water cycle USGS water science for schools
تاثیرات pb2 بر خون موجودات
سالهاست که سرب به عنوان نوعی آلوده کننده محیط زیست حیات موجودات زنده را تهدید می کند. غلظت سرب در چرخه های زیستی به چندین عامل از جمله خاک، گونه های گیاهی منطقه، ویژگی های آب و نوع کانی های آن بستگی دارد. هدف از این مطالعه اندازه گیری میزان تحرک سرب، قابل جذب بودن و نیز مشخص کردن اثر آن بر اندیس های خونی در حوالی معدن سرب فیض آباد راور است. بخش اولیه مطالعه نشان داد که غلظت سرب در آب، خاک و نیز گیاهان منطقه بالاست (در مقایسه با نمونه های مشابه از سایر مناطق)(P<0.05). به منظور بررسی جزئیات اثر سرب بر خون، نمونه های خونی، به صورت پرسشنامه ای از مردانی که در منطقه آلوده زندگی می کردند، گرفته شد (تعداد 24 نفر به عنوان گروه آزمونی ). سپس فاکتورهایی مثل Hg، MCH، MCHC، MCV، HCT و RBC اندازه گیری شدند. پس از مقایسه این فاکتورها با افراد مشابه از مناطق غیر آلوده (شهر راور) (24نفر به عنوان شاهد) نتایج زیر به دست آمد. هماتوکریت (HCT) و هموگلوبین (Hg) به طور معنی داری در افراد ساکن در محل آلوده نسبت به گروه شاهد پایین تر بود(P<0.05). اگرچه تعدادگلبول قرمز (RBC)، حجم متوسط گلبول قرمز(MCV)، مقدار هموگلوبین هر گلبول قرمز (MCH) و نیز غلظت هموگلوبین در یک گلبول قرمز (MCHC) تغییرات اندکی نشان دادند، اما این تغییرات به سطح معنی دار نمی رسد.نتیجه گیری این خواهد بود که ترکیبات سرب موجود در منطقه به صورت محلول در منابع آب می توانند به چرخه های زیستی وارد شوند و در نتیجه توسط بافت های زنده از جمله مغز استخوان جذب و بدین وسیله اندیس های خونی را متأثر سازند
آلودگی آب آشامیدنی توسط فلزات سنگین
فلزات سنگین با توجه به توسعه شهرنشینی و صنایع که منجر به افزایش میزان فاضلاب و پساب تولید گردیده است، عمدتا از طریق دفع نادرست و غیربهداشتی فاضلاب شهری و پساب صنعتی وارد محیط زیست می گردد. مرگ و میرهای آبزیان در اثر تخلیه پساب های محتوی فلزات سنگین در دنیا و ایران بی سابقه نیست. سبزیجات اطراف تهران نیز که با فاضلاب آبیاری میشود از این آلودگی ها بی بهره نمیباشد. فلزات سنگین شامل سرب، جیوه، روی، نیکل، کرم، کادمیوم و غیره میباشد. وجود فلزات سنگین در غلظت بیش از استاندارد در آب شرب باعث عوارض مختلف نظیر مسمومیت، حساسیت شدید، ضایعات کروموزومی، عقب افتادگی ذهنی، فراموشی، پارکینسن، سنگ کلیه، نرمی استخوان و انواع سرطان منجمله سرطان پروستات میگردد. یکی از کارشناسان محیط زیست، آلودگی محیط مخصوصا آب با فلزات سنگین را بعنوان بزرگترین گناهی که بشر در طبیعت انجام میدهد ارزیابی نموده است.
بیماریهای ناشی از آلودگی آبها به برخی عناصر: بچه های آبی
مطالعات جدید نشان داده است که کادمیم Cd اثرات ژنتیکی شدیدی بر روی انسان و حیوان دارد. مادرانی که در معرض آلودگی کادمیم قرار دارند, نوزادانی به دنیا می آورند که فک پایینی آنها تخریب شده است.
وجود آمونیاک در درجه اول و نیتریت در درجه دوم, موید آلودگی جدید آب است;در حالیکه وجود نیترات موید آلودگی کهنه آب است.
وجود نیترات و نیتریت در آبهای شهری برحسب میلیگرم در لیتر ازت نباید بیش از 10 باشد.
لزوم کم بودن مقادیر نیترات و نیتریت در آبهای شهری مربوط به نتایج تحقیقاتی می شود که بعد از یک واقعه غم انگیز که در حدود سالهای 1940 در شهرهای " اوهایو " ( Ohio ) و " یوا " ( Iowa ) آمریکا رخ داده بود, انجام یافت.
واقعه از این قرار بود که در آن سالها مرض مرموزی که موجب خفگی موضعی می شد, مابین اطفال خردسال این شهر به کرات ثبت می گردید. علت این مرض مرموز که بعدها نام متمو گلوبی نما Methmoglobinema به خود گرفت, موضوع پژوهش دانشمندان بود تا نتایج حاصله نشان داد که عامل اساسی, وجود مقادیر قابل ملاحظه ای نیترات در آبهای مشروب این شهرها بوده است.
در محیط معده اطفال که خاصیت اسیدی آن کم است, نیتراتها با هموگلوبین های خون ترکیب شده و تولید متهوگلوبین می نماید, در حالیکه وظیفه اصلی هموگلوبین ها, ترکیب با اکسیژن هوا در ششها و تولید اکسی هموگلوبین و تغذیه این اکسیژن به خون است.با تشکیل متهوگلوبین, طفل به تدریج دچار کمبود هموگلوبین شده که سرانجام پس از طی مراحلی منجر به خفگی کامل می گردد.
| پیوند داتیو ، در حقیقت همان پیوند کووالانسی است، فقط با کووالانسی این تفاوت را دارد که در کووالانسی دو الکترون مشترک بوسیله هر دو اتم به اشتراک گذاشته میشوند، ولی در داتیو ، دو الکترون مشترک ، فقط بوسیله یکی از اتمها به اشتراک گذاشته میشود و اتم مقابل در آنها شریک میگردد، بدون اینکه خود الکترونی به اشتراک کذاشته باشد. |
ارائه توسط مهسا فاتحی دلارام مجتبوی
هنگامی که انسان ها به زیر آب فرو می روند فشار در اطراف آنها به مقدار فوق العاده زیادی افزایش می یابد. برای جلوگیری از روی هم خوابیدن ریه ها ، هوا نیز بایستی تحت فشار زیاد رسانده شود و این امر خون در ریه ها را در معرض فشارهای فوق العاده زیاد گازهای حباب چه ای قرار می دهد که هیپرباریسم نامیده میشود. این فشارهای بالا در صورتی که از حدود معینی تجاوز کنند ، می توانند موجب تغییرات فوق العاده شدیدی در فیزیولوژی بدن شوند.
ستونی از آب دریا به ارتفاع 10 متر در ته خود فشاری برابر با یک اتمسفر ایجاد می کند. بنابراین شخصی که در 10 متری زیر سطح اقیانوس قرار داشته باشد، در معرض فشاری برابر با 2 اتمسفر قرار خواهد گرفت که یک اتمسفر آن مربوط به فشار هوای موجود در بالای آب و یک اتمسفر آن مربوط به وزن خود آب است.
? اثر فشارهای سهمی زیاد گازها بر روی بدن
گازهایی که غواص در هنگام استنشاق هوا بطور عادی در معرض آنها قرار دارد عبارتند از نیتروژن ، اکسیژن و دی اکسید کربن. هر یک از این گازها می توانند گاهی موجب اثرات فیزیولوژیک جدی در فشارهای زیاد شوند.
کلمه سورفکتانت مخلوطی از “Surface active agent “ می باشد . سورفکتانتها معمولا ترکیباتی آلی هستند که دارای گروههای هیدروفوبیک که نقش دم و دنباله را دارد و گروههای هیدروفیلیک که نقش سر را دارد می باشند بنابراین معمولا به طور ناچیز در آب و حلالهای آلی حل می شوند .
سورفکتانتها کشش سطحی آب را بوسیله جذب سطحی فصل مشترک هوا – آب کاهش می دهند همچنین باعث کاهش کشش فصل مشترک آب و روغن بوسیله جذب سطحی فصل مشترک مایع- مایع می شوند تعداد زیادی ملکول سورفکتانت می توانند در توده محلول به هم وصل شده و تشکیل توده ای داده ه به نام micelle دهند به غلظتی که در ان این micelle ها شروع به تشکیل شدن می کنند غلظت بحرانی تشکیل micelle یا CMC گویند وقتی micelle ها شروع به تشکیل شدن کردند دم انها تشکیل یک هسته مانند یک قطره روغن و سر یونی انها یک پوسته بیرونی می سازد که تماس مطلوب با اب را بهبود می بخشد
سورفکتانتها نقش مهمی در بسیاری از کاربرد ها عملی و محصولات بازی میکند مثلا : شونده ها - امولسیون کننده ها - جوهر سازی - کف سازی و ....
سورفکتانتها معمولا بوسیله گروههای باردار تقسیم بندی می شوند . سورفکتانتهای nonionic در قسمت سر خود بی بار هستند اگر بار منفی باشد سورفکتانت آنیونی و اگر مثبت بود سورفکتانت کاتیونی داریم .. گاهی قسمت سر دارای هر دو بار منفی و مثبت است که به آن آمفوتریک گوئیم .
عناوین یادداشتهای وبلاگ