 گازی به اسید سولفوریک اضافه میشود، الئوم یا اسید سولفوریک دود کننده به فرمول
گازی به اسید سولفوریک اضافه میشود، الئوم یا اسید سولفوریک دود کننده به فرمول 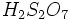 ایجاد میشود. واکنش اسید سولفوریک با آب بسیار گرمازا میباشد. اضافه کردن آب به اسید سولفوریک غلیظ خطرناک است. زیرا در اثر حرارت حاصل از واکنش اسید و آب ، آب داغ ممکن است به اطراف پراکنده شود.
ایجاد میشود. واکنش اسید سولفوریک با آب بسیار گرمازا میباشد. اضافه کردن آب به اسید سولفوریک غلیظ خطرناک است. زیرا در اثر حرارت حاصل از واکنش اسید و آب ، آب داغ ممکن است به اطراف پراکنده شود. حاصل از کارخانهها با آب باران بوجود میآید.
حاصل از کارخانهها با آب باران بوجود میآید. 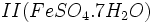 که زاج سبز نامیده میشود و سولفات مس
که زاج سبز نامیده میشود و سولفات مس 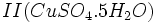 که کات کبود نامیده میشد بدست آورد. حرارت هر یک از این ترکیبات باعث تجزیه آنها و ایجاد اکسید آهن II یا اکسید مس II ، آب و
که کات کبود نامیده میشد بدست آورد. حرارت هر یک از این ترکیبات باعث تجزیه آنها و ایجاد اکسید آهن II یا اکسید مس II ، آب و 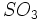 میگردد. ترکیب آب و
میگردد. ترکیب آب و  حاصل شده ، محلول رقیق اسید سولفوریک ایجاد میکند.
حاصل شده ، محلول رقیق اسید سولفوریک ایجاد میکند. ایجاد میکند. عبور دادن
ایجاد میکند. عبور دادن  به آرامی از میان آب ، اسید سولفوریک با غلظت بالا ایجاد میکند.
به آرامی از میان آب ، اسید سولفوریک با غلظت بالا ایجاد میکند.  و اسید سولفوریک غلیظ ابداع کرد که امروزه به نام فرآیند تماسی معروف است و قسمت اعظم اسید سولفوریک در دنیا به این روش تولید میگردد. این فرآیند در سه مرحله صورت میگیرد که عبارتند از :
و اسید سولفوریک غلیظ ابداع کرد که امروزه به نام فرآیند تماسی معروف است و قسمت اعظم اسید سولفوریک در دنیا به این روش تولید میگردد. این فرآیند در سه مرحله صورت میگیرد که عبارتند از : :
: و هوا برای جلوگیری از مسمومشدن کاتالیزور لازم است. گازها پس از شستشو با آب ، با اسید سولفوریک خشک میشوند.
و هوا برای جلوگیری از مسمومشدن کاتالیزور لازم است. گازها پس از شستشو با آب ، با اسید سولفوریک خشک میشوند. به
به  :
: با
با 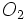 در دمای بالاتر از 450 درجه سانتیگراد و فشار 2atm و کاتالیزور پنتا اکسید وانادیم ، واکنش داده و
در دمای بالاتر از 450 درجه سانتیگراد و فشار 2atm و کاتالیزور پنتا اکسید وانادیم ، واکنش داده و  تولید میکند.
تولید میکند.  تولید شده از میان تبادلگر گرمایی عبور داده شده و در اسید سولفوریک غلیظ حل شده و تولید الئوم میکند. به دلیل اینکه انحلال
تولید شده از میان تبادلگر گرمایی عبور داده شده و در اسید سولفوریک غلیظ حل شده و تولید الئوم میکند. به دلیل اینکه انحلال  در آب بسیار گرمازا بوده و بجای اسید سولفوریک مایع ، مه تولید میشود، انحلال مستقیم
در آب بسیار گرمازا بوده و بجای اسید سولفوریک مایع ، مه تولید میشود، انحلال مستقیم  در آب عملی نمیباشد.
در آب عملی نمیباشد.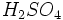 :
:|
خواص فیزیکی | |
| اسید سولفوریک | نام |
| H2SO4 | فرمول |
| مایع بیرنگ | ظاهر |
| 98gr/mol | وزن مولکولی |
| 10 درجه سانتیگراد | دمای ذوب |
| 337 درجه سانتیگراد | نقطه جوش |
| 1.8gr/cm3 | دانسیته |
در دنیای دانش و فناوری، علوم گوناگونی وجود دارند که هر یک به نوبه خود و با توجه به اکتشافات و اختراعات وابسته به آن علم، خودنمایی میکنند؛ علومی همچون فیزیک، شیمی، ریاضی و... دانشمندان علم فیزیک بر این باورند که مادر همگی علوم، علم فیزیک است.
اصول اصلی «ترموداینامیک» بیانگر این خاصیت ترانهادگی متغیر دماست؛ بر این اساس که دو جسم همدما در تقابل با جسم سوم، به دمای یکسان میرسند.
دیگر اینکه «ترموداینامیک» بیانگر پایستاری انرژی درونی است. انرژی درونی عبارت است از «تفاضل انرژی حرارتی داده شده به انرژی بکار گرفته شده.» به عنوان مثال اگر دو جسم گرم و سرد را در مجاورت یکدیگر قرار دهیم، باعث تغییر دمای هر دو جسم منتهی خواهد شد. در صورت برقراربودن سیستم منزوی، کار انجامشده برابر صفر است و نتیجه اینکه، انرژی درونی هر جسمی برابر خواهد بود با انرژی گرمایی اولیه آن و تغییرات آن. خب! این قابل تشخیص است که مجموع آن دو برابر میشود با مجموع انرژیهای اولیه هر دو جسم که این خود برابر است با قانون بقای انرژی. انرژی هرگز از بین نمیرود، بلکه از حالتی به حالت دیگر تبدیل میگردد. این را همه ما در طول سالهای تحصیلی به فراخور، در دروس مختلف خواندهایم.
در اصلی دیگر از ترموداینامیک آمده است: «هنگامی که دو جسم گرم و سرد در مجاورت هم قرار میگیرند، حرارت از جسم گرم به جسم سرد منتقل میشود» و این هم یعنی تبادل دما. و دیگر اینکه ترمودینامیک بیانگر این نکته است که صفر مطلق دما، منطقهای است که هرگز نمیتوان به آن رسید یا از آن پایینتر رفت. اصل ترموداینامیک را میتوان توسط متغیر آنتروپی مدل کرد که تغییر آن برابر با تغییر گرمای تبادلشده تقسیم بر دماست؛ به عبارتی هر سیستمی همواره در جهتی حرکت میکند که مجموع آنتروپی سیستم و محیط، افزایش پیدا کند. به عنوان مثال، اگر دو مخزن آب ایزوله از هم، یکی 25درجه و همان میزان آب در مخزن دیگر 75درجه با هم مخلوط شوند و یا یکی صفر درجه و دیگری صد درجه. در حالت اول، میانگین میتواند چیزی حدود 40 و 60 باشد و در حالت دوم 10 و 90. بهتر است که بحث را در همینجا تمام کنیم که این مبحث هزاران ساعت برای مباحثه وقت میطلبد. تمامی این موارد گفته شد تا علم ترموداینامیک به صورت هر چند خلاصه بیان شود و هستند دانشمندان و فیزیکدانهایی که با این قوانین و اصول، صبح را به شب و شب را به صبح میرسانند و آنچنان اعتقادی به این اصول دارند که همچون بت به پرستش آن میپردازند و اگر کسی کوچکترین اختلاف نظری داشته باشد، از جانب این قبیل افراد تکفیر میشود. سالها این قوانین در علم فیزیک بود و به اثبات هم رسیده بود و هست اما یکباره یک آگهی در مجله بسیار معتبر «اکونومیست» آتش به جان هزاران فیزیکدان انداخته و دنیای علوم فیزیک و خصوصاً ترموداینامیک را به چالش کشانده است.
دانشمندان سالیان سال آرزو داشتند تا دستگاهی اختراع کنند که قادر به تولید یک میزان بینهایت از انرژی باشد، اما هرگز نتوانسته بودند. حتی خود «لئوناردو داوینچی» نیز این کار را غیرممکن دانسته بود و به دانشمندان گفته بود که شما راه خطایی پیش رفتهاید ولی گویی مهندسین شرکت «اس-تی- اورن» (Steorn) اذعان دارند که انتظار به سر رسیده و این امر تحقق یافته و تحقیقات آنان به پایان رسیده است. بازرگانانی که پشتیبان مالی این پروژه هستند نیز میگویند: «نهتنها گردش این تجهیزات به طور خودگردان مؤید این موفقیت است، بلکه هنگامی که این دستگاه مولد میچرخد، یک انرژی، بیش از مقدار مصرف خود تولید میکند».
دکتر «شان مکآرتی» مدیر عامل شرکت «اس- تی- اورن» در همین زمینه گفت: «تحقیقات ما نشان داده است که اگر از یک میدان مغناطیسی ویژهای، آهنرباهای دائمی عبور کنند، با ایستادن و حرکت در یک زمان میتوان انرژی تولید کرد». آقای مکآرتی که خود از فیزیکدانان خبره است، گفت: «ما این پدیده را بهطور کاملاً اتفاقی سه سال قبل کشف کردیم و در طول این سالها بارها و بارها مورد آزمایش و تجزیه و تحلیل قرار دادیم تا مورد تمسخر و استهزا قرار نگیریم».
اذعان بر این کشف، باعث واکنشهای عجیب و گاه خشمگینانه از سوی دانشمندان گردیده است.
آقای مکآرتی میگوید: «مسئولان این پروژه همهروزه نامههای تهدیدآمیزی از طریق پست دریافت میکنند. برخی از این نامهها به دفاتر «اس – تی- اورن» و برخی دیگر از نامهها حتی به منازل دانشمندان مرکز «اس – تی- اورن» ارسال شدهاند».
شرکت «اس – تی- اورن» در این ارتباط با چاپ یک آگهی در مجله معتبر «اکونومیست» از دانشمندان دعوت کرده است که برای دیدن و امتحان این پروژه به هیأت علمی 12نفره آنان بپیوندند.
آقای مکآرتی میگوید: «علم ترموداینامیک دارای 2 اصل مهم و بنیادی است؛ اول آنکه انرژی را نه میتوان تولید کرد و نه میتوان نابود کرد ولی میتوان آن را از نوعی به نوع دیگر تبدیل کرد و دوم آنکه اگر انرژی وارد یک سیستم شود، نمیتوان تمامی آن انرژی را از سیستم به بیرون آورد. اگرچه ممکن است آزمایشات در این زمینه سالها طول بکشد، در عین حال نیز میتواند همراه با ریسک باشد. کارکنان ما در شرکت «اس – تی- اورن» میدانند که اگر جواب دانشمندان، جواب موافقی نباشد شرکت، مورد تمسخر جهانیان قرار خواهد گرفت».
کارشناسان میگویند اگر این اختراع مورد تایید قرار گیرد، پاداش بسیار بزرگ و بیحدوحصری از نظر مالی، با ثبت این اختراع برای شرکت «اس- تی – اورن» به همراه خواهد داشت.
در ابتدای این مطلب بهتر است تعریفی از کریستال داشته باشیم:
یک ساختار کریستالین در واقع در نتیجه اتصال اتم ها و مولکولها (Packing) در یک شبکه بلوری خاص می باشد.در کل 14 شبکه بلورین وجود دارد که ترکیبات به طور کلی در این شبکه ها متبلور می شوند.
همانگونه که می دانیم تکنیکهای گسترده ای مانند: IR,NMR,Mass,ESR,Uv جهت شناسایی مواد وجود دارند که عموماً نمی توان با استفاده از یکی از آنها شناسایی دقیقی انجام داد.در واقع تنها تکنیکی که به ما ساختار دقیق ، جهت گیری فضایی و طول پیوندها را می دهد XRD یا تکنیک پراش اشعه X است.برای به کار گیری این تکنیک ما باید ترکیب مورد نظر را کریستاله کنیم.
قطر مناسب کریستال برای استفاده در این تکنیک بین 5/0 تا 45/0 میلی متر می باشد.
اما برای تهیه کریستال تکنیکهای بیشماری وجود دارد که معمولاً هر تکنیکی برای یک دسته از ترکیبات مناسبتر است.ابتدا باید نکاتی از قبیل پایداری و حساسیت های ترکیب سنتز شده (اکسید شدن ? جذب آب ، تفکیک شدن دمایی و...) در نظر گرفته شود.
مهمترین مرحله برای کریستاله کردن انتخاب حلال است.همچنین خالص بودن ترکیب بسیار بسیار مهم است (در صورت وجود ناخالصی یک مخلوط روغنی در ته ظرف بوجود می آید).پس خالص سازی ترکیب گام نخست است (توسط حل کردن مجدد در حلال مناسب و سپس صاف کردن).انتخاب ظرف برای کریستاله کردن هم می تواند مهم باشد.بهترین حالت استفاده از ظروف با تحدب یکنواخت (مثل بالون یا ارلن) که تمیز و در عین حال خش دار (سایتهای مناسب برای القاء کریستالیزاسیون) می باشد.
یکی از عمومی ترین این روشها، کریستالیزه کردن بوسیله تبخیر آهسته حلال است.به این منظور بهترین حلال ،حلالی است که نقطه جوش پایین و فراریت بالایی داشته در ضمن ترکیب مورد نظر را هم با کمی حرارت کاملاً در خود حل کند.ازمناسبترین این حلالها می توان ،اتانول (EtOH)با نقطه جوش 78 درجه،استونیتریل(CH3CN) با نقطه جوش 76 ،دی کلرو متان (CH2Cl2) با نقطه جوش 42 را نام برد.
جدول تناوبی عناصر شیمیایی نمایشی از عناصر شیمیایی است که براساس ساختار الکترونی مرتب شده است، بطوریکه بسیاری از خواص شیمیایی بصورت منظم در طول جدول تغییر نماید. جدول اولیه بدون اطلاع از ساختار داخلی اتمها ساخته شد: اگر عناصر را بر حسب جرم اتمی آنها مرتب نمائیم، و آنگاه نمودار خواص معین دیگر آنها را بر حسب جرم اتمی رسم نمائیم، میتوان نوسان یا تناوب این خواص را بصورت تابعی از جرم اتمی مشاهده نمود. اولین کسی که توانست این نظم را مشاهده نماید، یک شیمیدان آلمانی به نام Johann Wolfgang D?einer بود. او متوجه تعدادی تثلیث از عناصر مشابه شد:
نمونه تثلیث ها
عنصر جرم اتمی چگالی------ عنصر جرم اتمی چگالی
Cl 35.5 1.56 g/L ------ Ca 40.1 1.55 g/cm3
Br 79.9 3.12 g/L ------ Sr 87.6 2.6 g/cm3
I 126.9 4.95 g/L ------ Ba 137 3.5 g/cm3
و به دنبال او، شیمیدان انگلیسی John Alexander Reina Newlands متوجه گردید که عناصر از نوع مشابه در فاصلههای هشت تایی یافت می شوند، که آنها را با نتهای هشتگانه موسیقی شبیه نمود، هرچند که قانون نتهای او مورد تمسخر معاصرین او قرار گرفت. سرانجام شیمیدان آلمانی Lothar Meyer و شیمیدان روسی Dmitry Ivanovich Mendeleev تقریبا بطور همزمان اولین جدول تناوبی را، با مرتب نمودن عناصر بر حسب جرمشان، توسعه دادند (ولی مندلیف تعداد کمی از عناصر را خارج از ترتیب صریح جرمی، برای تطابق بهتر با خواص همسایگانشان رسم نمود. این کار بعدها با کشف ساختار الکترونی عناصر در اواخر قرن نوزدهم و اوایل قرن بیستم توجیه گردید). فهرست عناصر بر اساس نام، علامت اختصاری و عدد اتمی موجود میباشد. شکل زیر جدول تناوبی عناصر شناخته شده را نمایش میدهد. هر عنصر با عدد اتمی و علامتهای شیمیایی. عناصر در یک ستون ("گروه") از لحاظ شیمیایی مشابه می باشند.
کد رنگ برای اعداد اتمی:
عناصر شماره گذاری شده با رنگ آبی ، در دمای اتاق مایع هستند؛
عناصر شماره گذاری شده با رنگ سبز ، در دمای اتاق بصورت گاز می باشند؛
عناصر شماره گذاری شده با رنگ سیاه ، در دمای اتاق جامد هستند.
عناصر شماره گذاری شده با رنگ قرمز ، ترکیبی بوده و بطور طبیعی یافت نمی شوند(همه در دمای اتاق جامد هستند)
عناصر شماره گذاری شده با رنگ خاکستری ، هنوز کشف نشدهاند (و بصورت کم رنگ نشان داده شدهاند تا گروه شیمیایی را که در آن قرار می گیرند، مشخص نماید.(
و می توانید دراین کلید واژه جدول برای تشدید مغناطیسی را بیابید.
تعداد لایه الکترون در یک اتم تعیین کننده ردیفی است که در آن قرار می گیرد. هر لایه به زیرلایه های متفاوتی تقسیم میشود، که هر اندازه عدد اتمی افزایش می یابد، این لایه ها به ترتیب زیر:
1s
2s 2p
3s 3p
4s 3d 4p
5s 4d 5p
6s 4f 5d 6p
7s 5f 6d 7p
8s 5g 6f 7d 8p
...
براساس ساختار جدول پر میشوند. از آنجائیکه الکترونهای خارجی ترین لایه، خواص شیمیایی را تعیین مینمایند، این لایه ها در میان گروهای یکسان مشابه اند.عناصر همجوار با یکدیگر در یک گروه، علیرغم اختلاف مهم در جرم، دارای خواص فیزیکی مشابه میباشند. عناصر همجوار با یکدیگر در یک ردیف دارای جرم های مشابه ولی خواص متفاوت میباشند.
برای مثال، عناصر بسیار نزدیک به نیتروژن (N) در ردیف دوم کربن(C) و اکسیژن(O) میباشند. علیرغم تشابه آنها در جرم ( که بصورت ناچیزی در واحد جرم اتمی تفاوت دارند)، دارای خواص بینهایت متفاوتی هستند، همانطور که با بررسی فرمهای دیگر میتوان ملاحظه نمود: اکسیژن دو اتمی یک کاز است که سوختن را تشدید می نماید، نیتروژن دو اتمی یک گاز است که سوختن را تشدید نمی کند، و کربن یک جامد است که میتواند سوزانده شود( بله، میتوان الماس را سوزاند(
در مقایسه، عناصر بسیار نزدیک به کلر (Cl) در گروه یکی مانده به آخر در جدول «هالوژنها) فلوئور( F) و برم( Br) میباشند. علیرغم تفاوت فاحش جرم آنها در گروه، فرمهای دیگر آنها دارای خواص بسیار مشابه میباشند: آنها بسیار خورنده ( بدین معنی که تمایل خوبی برای ترکیب با فلزات، برای تشکیل نمک هالاید فلز)؛ کلر و فلوئور گاز هستند، درحالیکه برم یک مایع با تبخیر بسیار کم میباشد؛ کلر و برم بسیار رنگی هستند.
نرم افزاری جالب برای محاسبات شیمی مانند محلول سازی و... که میتوانید این نرم افزار مفید و جالب را از لینک زیر دانلود کنید:
Size: 969 KB
دانلود
فشار هر بخار در حالت تعادل با مایع خود در دمای معین را فشار بخار تعادل آن مایع مینامیم.
حالت تعادل
اگر مایعی در یک ظرف سربسته بخار شود، مولکولهای بخار نمیتوانند از نزدیکی مایع دور شوند و تعدادی از مولکولهای بخار ضمن حرکت نامنظم خود، به فاز مایع بر میگردند. این فرآیند را برای آب میتوان با پیکان دوگانه نشان داد:
(H2O(l)?H2O(g
سرعت برگشت مولکولهای بخار به فاز مایع، به غلظت مولکولها در بخار بستگی دارد. هر چه تعداد مولکولها در حجم معینی از بخار باشد، تعداد مولکولهایی که به سطح مایع برخورد کرده، مجددا گیر میافتند، بیشتر خواهد بود. در آغاز، چون تعداد کمی مولکول در بخار وجود دارد، سرعت بازگشت مولکولها از بخار به مایع کم است. ولی ادامه تبخیر، موجب افزایش غلظت مولکولها در بخار میشود و در نتیجه، سرعت تراکم افزایش مییابد.
سرانجام، سیستم به حالتی میرسد که در آن حالت، سرعت تراکم و تبخیر برابر میشود. حالتی که در آن، سرعتهای دو تمایل مخالف (تبخیر و تراکم) با هم برابر میشوند، حالت تعادل نامیده میشود.
وضعیت مولکولها در حالت تعادل در حالت تعادل، غلظت مولکولها در فاز بخار ثابت است، زیرا مولکولها با همان سرعتی که بر اثر تراکم (میعان) از فاز بخار خارج میشوند، بر اثر تبخیر در این فاز وارد میشوند. به همین منوال، مقدار مایع نیز در حالت تعادل ثابت است، زیرا مولکولها با همان سرعتی که به مایع برمیگردند، بر اثر تبخیر آن را ترک میکنند.
باید توجه داشت که حالت تعادل، دال بر این نیست که هیچ حادثه ای رخ نمیدهد؛ در هر سیستمی، ثابت ماندن تعداد مولکولها در هر یک از دو فاز مایع و بخار نه بهعلت متوقف شدن تبخیر و تراکم، بلکه به علت برابری این دو تغییر متقابل است.
فشار بخار و حالت تعادل
چون در حالت تعادل، غلظت مولکولها در فاز بخار ثابت است، فشار بخار نیز ثابت است. فشار هر بخار در حالت تعادل با مایع خود در دمای معین را فشار بخار تعادل آن مایع مینامیم. فشار بخار هر مایع، تابع دماست و با افزایش آن زیاد میشود. افزایش دما با افزایش فشار بخار همراه است. فشار بخار در دمای بحرانی است. بالاتر از دمای بحرانی تنها یک فاز میتواند وجود داشته باشد، یعنی فازهای گاز و مایع متمایز از یکدیگر نیستند.
فشار بخار و نیروهای جاذبه بین مولکولی مقدار فشار بخار یک مایع، معیاری از قدرت نیروهای جاذبه بین مولکولی آن مایع را بدست میدهد. مایعاتی که نیروهای جاذبه قوی دارند، فشار بخار آنها کم است. در ? 20 سانتیگراد، فشار بخار آب، اتیل الکل و دی اتیل اتر به ترتیب 0.023 atm 0,058 ، atm و 0.582 atm است. از این رو، نیروهای جاذبه در آب قویترین و در دیاتیل اتر ضعیفترین است.
عناوین یادداشتهای وبلاگ