ضریب مولی یا ضریب استوکیومتری چیست :
ضریب استوکیومتری عددی است که در سمت چپ نماد شیمیایی یک عنصر یا فرمول شیمیایی یک ترکیب قرار می گیرد و تعداد آن را مشخص می کند. مثلا وقتی می نویسیم 5Fe عدد 5 ضریب استوکیومتری یا ضریب مولی آهن را نشان می دهد و مفهوم آن پنج اتم آهن است. یا وقتی می نویسیم 3H2O ، عدد سه ضریب استوکیومتری آب را نشان می دهد، یعنی سه مولکول آب. ضریب استوکیومتری یک ترکیب علاوه بر آنکه تعداد واحد فرمولی آن ترکیب را نشان می دهد، در شمارش اتمهای سازنده آن ترکیب نیز محاسبه می شود.
مثال :
نویسنده: هربرت بیل و جان تریمبر
مترجم: دکتر مهدی بکاولی
این کتاب با تاکید بر روشهای آزمایش، ارزیابی، تصحیح و به اشتراک گذاشتن نظرات مختلف، راهنمای فشرده ای در روش تحقیق برای شیمیدانها فراهم می کند تا به کمک آن مهارت خود را در برقراری ارتباط با زمینه کاری شان افزایش دهند. در این کتاب برنامه های گرافیکی، فرمت ACS و راهنمای نقل قول علمی، راهنمای مرک و خلاصه ای از روشهای تحقیق آورده شده است، ضمن اینکه ویرایش جدید کتاب شامل روش های کار با کامپیوتر، جستجو در اینترنت و منابع الکترونیک مورد نیاز شیمیدانان نیز میباشد.
مطالعه این کتاب را به دانشجویان شیمی که علاقمند به پژوهش می باشند، توصیه می کنم.
دیمتری. ایوانویچ. مندلیف زیر و رو کننده علم شیمی و فرزند یکی از مدیران مدرسه محلی در هفتم فوریه 1834 در شهر «توبوسک» واقع در روسیه متولد شد وی در سال 1869 دکتر علوم و استاد شیمی دانشگاه شد و در همین سال ازدواج کرد در این هنگام فقط شصت و سه عنصر از نظر شیمی دانها شناخته شده بود مندلیف در این فکر بود که خواص فیزیکی و شیمیای عناصر تابعی از جرم اتمی آنهاست. بدون قانون تناوبی نه پیش بینی خواص عناصر شیمیایی ناشناخته میسر بود و نه به فقدان یا غیبت برخی از عناصر می شد پی برد کشف عناصر منوط به مشاهده و بررسی بود بنابراین تنها یاری بخت، مداومت و یا پیش داوری منجر به کشف عناصر جدید می شد قانون تناوبی راه جدیدی در این زمینه گشود منظور مندلیف از این جمله ها آن بود که در سیر تاریخی عناصر شیمیایی، زمان حدس زدن وجود عناصر و پیشگویی خواص مهمشان فرا رسیده است. جدول تناوبی پایه ای برای این کار شد حتی ساخت این جدول نشان می داد که در چه جاهایی مکان خالی باقی می ماند که باید بعداً اشغال شود. با آگاهی از خواص عناصر موجود در جوار این مکانهای خالی می شد خواص مهم عناصر ناشناس را تخمین زد و چند مشخصه مقداری آنها (جرمهای اتمی، چگالی، نقطه ذوب و نقطه جوشش و مانند آنها را) به کمک نتیجه گیریهای منطقی و چند محاسبه ریاضی ساده، تعیین کرد. این مطالب نیاز به تبحر کافی در شیمی داشت مندلیف از این تبحر برخوردار بود که با ترکیب آن با تلاش علمی و اعتقاد به قانون تناوبی توانست پیشگوهای درخشانی درباره وجود و خواص چندین عنصر جدید را ارائه دهد بنابراین مطابق با این فکر جدولی درست کرد و شصت و سه عنصر شناخته شده را به ترتیب جرم اتمیشان در جدول قرار داد تعداد عناصر در سطرهای جدول یکی نبود مثلاً سطر پنجم 32 عنصر داشت در حالیکه سطر ششم فقط شامل 6 عنصر بود ولی عناصری که خواص آنها شبیه هم بود در این جدول نزدیک هم قرار داشتند و بدین علت مقداری از خانه های جدول خالی ماند. مندلیف در مورد خانه های خالی اظهار داشت که خانه های خالی متعلق به عناصری است که تاکنون شناخته نشده وی این نتیجه را در سال 1869 به جامعه شیمی روسیه تقدیم کرد . جدول مندلیف که پیش بینی وجود 92 عنصر را می نمود جز لوترمایز که یک سال بعد از مندلیف جدولی مشابه با جدول مندلیف انتشار داده بود طرفداری نداشت پیش بینی های عجیب مندلیف زمان درازی به صورت مثالهای موجود در همه کتابهای شیمی در آمده بود و کمتر کتاب شیمی وجود دارد که در آن از اکاآلومینیوم و اکابور و اکاسیلیسیم یاد نشده باشد که بعدها پس از کشف به نامهای گالیوم، سکاندیوم ژرمانیوم نامیده شدند در میان سه عنصری که مندلیف پیش بینی کرده بود اکاسیلیوم بعد از سایرین کشف شد. (1887) و کشف آن بیش از کشف دو عنصر دیگر مرهون یاری بخت و تصادف مساعد بود. در واقع کشف گالیوم توسط بوابودران (1875) مستقیماً تحت توسط روشهای طیف سنجیش بود و جدا کردن سکاندیوم توسط نیلسون و کلو (1879) مربوط به بررسی دقیق خاکهای نادر بود که درآن زمان اوج گرفته بود اندک اندک همه پیشگویی های مندلیف تحقق یافته اند. آخرین تأیید در مورد وزن مخصوص سکاندیوم فلزی بود در سال 1937 فیشر شیمیدان آلمانی موفق به تهیه سکاندیوم با درجه خلوص 98 درصد شد وزن مخصوص آن سه گرم بر سانتی متر مکعب بود این دقیقاً همان رقمی است که مندلیف پیش بینی کرده بود در پاییز سال 1879 انگلس کتاب جامعی به دست آورد که نویسندگانش روسکو و شورلمر بودند در آن کتاب برای نخستین بار به پیشگویی اکاآلومینیوم توسط مندلیف و کشفش تحت نام گالیوم اشاره شده بود در مقاله ای که بعدها انگلس در کتابی هم نقل کرده است، اشاره به مطلب آن کتاب شیمی شده است و نتیجه گرفته است که: «مندلیف با به کار بردن ناخودآگاه قانون تبدیل کمیت به کیفیت هگل، واقعیت علمی ای را تحقق بخشید که از نظر تهور فقط قابل قیاس با کار لوریه در محاسبه مدار سیاره ناشناخته نپتون بوده است.
علاوه بر این با اکتشاف آرگون در سال 1894 و هلیوم و اینکه «رامزی» نظریه جدول مندلیف وجود نئون و کریپتون و گزنون را پیش بینی نمود جدول مندلیف شهرت عجیب و فوق العاده ای کسب نمود. در این سالها بود که تمامی آکادمی های کشورهای جهان (غیر از مملکت خودش) او را به عضویت دعوت نمودند زیرا مندلیف مردی آزادیخواه و طرفدار جدی حقوق زن بود و به این علت مورد لطف قرار نگرفت مندلیف در دوم فوریه 1907 در هفتاد و سه سالگی درگذشت به طوری که می دانیم از هنگامی که جدول مندلیف بوجود آمد خانه های خالی آن یکی پس از دیگری با کشف عناصر پر می شد و آخرین خانه خالی جدول در سال 1938 با کشف (آکتینوم) در پاریس پر شد.
تاریخچه
لیتیم را (واژه یونانی lithos به معنی سنگ) ، “Johann Arfvedson” در سال 1817 کشف کرد. “Arfvedson” این عنصر جدید را هنگامیکه در سوئد مشغول تجزیه و تحلیل بود، با مواد معدنی اسپادومین و لپدولیت دریک کانی پتالیت کشف نمود. “Christian Gmelin” در سال 1818 ، اولین کسی بود که شاهد قرمزرنگ شدن نمک لیتیم در شعله آتش بود. اما هر دوی این افراد ، در جداسازی این عنصر از نمکش ناکام ماندند.
این عنصر را برای اولین بار “W.T. Brande” و “Humphrey Davy” با استفاده از الکترولیز اکسید لیتیم جدا کردند. تولید تجاری فلز لیتیم در سال 1923 بوسیله شرکت آلمانی Metallgesellschaft AG و با استفاده از الکترولیز کلرید لیتیم و کلرید پتاسیم مذاب محقق گشت. ظاهرا” نام لیتیم به این علت انتخاب شد که این عنصر در یک ماده معدنی کشف شد، در حالیکه سایر فلزات قلیایی اولین بار در بافتهای گیاهی دیده شدهاند.
اطلاعات کلی
لیتیم ، عنصر شیمیایی است، با نشان Li و عدد اتمی 3 که در جدول تناوبی به همراه فلزات قلیایی در گروه 1 قرار دارد. این عنصر در حالت خالص ، فلزی نرم و به رنگ سفید خاکستری میباشد که بهسرعت در معرض آب و هوا اکسید شده ، کدر میگردد. لیتیم ، سبکترین عنصر جامد بوده ، عمدتا” در آلیاژهای انتقال حرارت ، در باطریها بکار رفته ، در بعضی از تثبیتکنندههای حالت mood stabilizers مورد استفاده قرار میگیرد.
خصوصیات قابل توجه
لیتیم ، سبکترین فلزات و دارای چگالی به اندازه نصف چگالی آب است. این عنصر همانند همه فلزات قلیایی بهراحتی در آب واکنش داده ، به سبب فعالیتش هرگز در طبیعت بصورت آزاد یافت نمیشود. با این وجود ، هنوز هم واکنشپذیری آن از سدیم کمتر است. وقتی لیتیم روی شعله قرار گیرد، رنگ زرشکی جالبی تولید میکند، اما اگر به شدت بسوزد، شعلههایی سفید درخشان ایجاد میکند. هنچنین لیتیم ، عنصری تکظرفیتی است.
کاربردها
لیتیم ، بهعلت گرمای ویژه اش ( بالاتر از تمامی جامدات) در انتقال حرارت مورد استفاده قرار میگیرد. بهعلت خاصیت electrochemical ، ماده مهمی در آند باطریها محسوب میشود. سایر کاربردها:
* نمکهای لیتیم ، مثل کربنات لیتیم ( Li2CO3 ) و سیترات لیتیم ، تثبیتکنندههای حالت هستند که در درمان بیماریهای متضاد نقش دارند.
* لیتیم کلرید و لیتیم برمید ، بهشدت رطوبت را جذب میکنند، لذا در خشک کنندهها بهکرات کاربرد دارند.
* استارات لیتیم ، یک ماده لیز کننده کلی در دمای بالا و برای تمامی مقاصد به شمار میرود.
* لیتیم ، عاملی آلیاژ ساز است که در تولید ترکیبات آلی مورد استفاده قرار گرفته ، نیز دارای کاربردهای اتمی میباشد.
* گاهی اوقات از لیتیم در ساخت شیشه و سرامیک استفاده میگردد، مانند شیشههای 200 اینچی تلســـــکوپ در Mt. Palomat.
* در فضاپیماها و زیردریائی ، برای خارج کردن دیاکسید کربن ازهوا از هیدروکسید لیتیم استفاده میشود.
* از آلیاژ این فلز با آلومینیوم ، کادمیم ، مس و منگنز در ساخت قطعات هواپیماهای بلند پرواز استفاده میگردد.
پیدایش
لیتیم بسیار پراکنده است، اما بهعلت واکنشپذیری زیادی که دارد، در طبیعت بصورت آزاد وجود ندارد و همیشه بصورت ترکیب با یک یا چند عنصر یا ترکیب دیگر دیده میشود. این فلز بخش کوچکی از کلیه سنگهای آذرین را تشکیل داده ، نیز در بسیاری از شورابهای طبیعی وجود دارد.
تولید لیتیم از پایان جنگ جهانی دوم بهشدت افزایش یافت. این فلز در سنگهای آذرین از سایر عناصر جدا میشود و از آب چشمههای معدنی هم بدست میآید. لپدولیت ، اسپادومین ، پتالیت و امبلی گونیت ، مهمترین مواد معدنی حاوی لیتیم هستند.
در آمریکا ، لیتیم را از شورابهای واقع در Searles Lake خشکیده در کالیفرنیا ، مناطقی از Nevada و نقاط دیگر بازیافت میکنند. این فلز که همانند سدیم ، پتاسیم و سایر اعضاء گروه فلزات قلیایی ، ظاهری سیمگون دارد، با روش الکترولیز از یک مخلوط لیتیم و کلرید پتاسیم گداخته تولید میشود. قیمت هر پوند لیتیم در سال 1997 ، 300 دلار آمریکا بود. جداسازی آن بصورت زیر است:
کاتد: *Li+* + e → Li
آند: -Cl-* → 1/2 Cl2 (gas) + e
ایزوتوپ ها
لیتیم ، بطور طبیعی متشکل از 2 ایزوتوپ پایدار Li-7 و Li-6 است که Li-7 فراوانتر است ( وفور طبیعی 5/92%). 6 رادیوایزوتوپ هم برای آن وجود دارد که پایدارترین آنها ، Li-8 با نیمه عمر 838 هزارم ثانیه و Li-9 با نیمه عمـــــــر 3/178 هزارم ثانیه میباشد. مابقی ایزوتوپهای رادیواکتیو ، نیمه عمرهایی کمتر از 8,5 هزارم ثانیه داشته یا ناشناختهاند.
ایزوتوپهای لیتیم طی یک سری فرآیندهای طبیعی مختلف از جمله تشکیل مواد معدنی ( رسوب شیمیایی) ، متابولیسم ،(جابجائی یونی ،(در برخی از خاکهای معدنی که Li-6 به Li-7 ترجیح داده شده است در مکانهای octahedral ، لیتیم جایگزین منیزیم و آهن میشود) ، hyperfiltration و دگرگونی صخرهها ، بطور اساسی شکسته میشوند.
هشدارها
لیتیم همانند فلزات قلیایی دیگر در حالت خالص ، شدیدا” آتش زا و در معرض هوا و مخصوصا” آب تا حدی انفجاری است. این فلز همچنین خورنده بوده ، لذا باید توجه خاص داشت و از تماس آن با پوست بدن اجتناب کرد. در صورت ذخیره ، باید آنرا در هیدروکربن مایع قابل اشتعالی مانند نفت نگهداری نمود. لیتیم ، هیچگونه نقش بیولوژیکی نداشته ، تا حدی سمی محسوب میشود.
منبعhttp://www.academist.ir/?p=643
سدیم یکی از عناصر متداول موجود در پوسته زمین است به طوری که 6/2 درصد پوسته زمین را ترکیبهای سدیم دار تشکیل میدهد. مهم ترین ترکیب آن نمک خوراکی یا سدیم کلراید است .
نمک خوراکی را میتوان از آب دریا یا سنگ نمک بدست آورد . سدیم از نظر واکنش پذیری بسیار شبیه عنصر همگروه خود لیتیم عمل میکند . بنابر این استخراج آن از سنگ نمک به دشواری انجام میشود.
برای استخراج سدیم از الکترولیز نمک آن استفاده می شود. سلول الکترولیزی آن سلول داون نامیده میشود.
در این سلول ،سدیم کلراید ذوب میشود .پس جریان الکتریکی را از خود عبور میدهد .یونهای کلراید به سمت آْند کشیده می شوند . به جایی که در آن اکترون از دست می دهند:
2Cl- – 2e ==è Cl2
پس در آند گاز کلر تشکیل میشود . یونهای کلر الکترون از دست می دهند و اکسید می شوند.
یونهای سدیم به سمت کاتد کشیده می شوند در اینجا هر یون سدیم یک اکترون می گیرد:
Na+ + e ==è Na
پس در کاتد سدیم مذاب تشکیل میشود .همانطور که یونهای سدیم الکترون میگیرند کاهش می یابند.
جدا نگهداشتن سدیم مایع از کلر، ضروری و مهم است زیرا این دو برای تشکیل دوباره سدیم کلراید به شدت با هم واکنش میدهند.
از آنجا که سدیم فلزی بسیار واکنش پذیر است، معمولا به صورت همراه با فلزهای دیگر کمتر کاربرد دارد .این فلز با آب به شدت واکنش میدهد پس میتوان نتیجه گرفت که در محیط مرطوب چندان کاربرد ندارد.
به هر حال بالا بودن واکنش پذیری آن، به این معناست که میتوان در استخراج تیتانیم از تیتانیم کلراید ،از سدیم استفاده کرد :
TiCl4 + 4Na ==è 4NaCl + Ti
معمولا در این واکنش،به جای سدیم ،بیشتر از منیزیم استفاده می شود .
از سدیم می توان به عنوان خنک کننده در نیروگاههای هسته ای استفاده کرد. به این ترتیب ،گرما از راکتورهای داغ به دیگ های بخار ( جایی که آب به جوش می آید )منتقل میشود.
سدیم برای این کار مناسب است زیرا هدایت کننده گرمایی مناسبی است.هنگامی که ذوب میشود به آسانی جاری میشود و در گستره ی بسیار وسیعی از دما به حالت مایع وجود دارد.
سدیم در 98 0Cذوب میشود و تا دما به 891 0C نرسد ،نمی جوشد،اما سدیم مایع را هنگامی که داغ است باید از رطوبت دور نگه داشت.
لامپهای زرد خیابان، دارای بخار سدیم هستند. به ازای هر ژول انرژی الکتریکی که به بخار سدیم میرسد،مقدار زیادی نور مریی از آن بیرون می آید . به همین علت این لامپ ها ارزان هستند.
منبع :http://www.academist.ir/?p=371
برای بررسی ایزوتوپها از طیف نگار جرمی استفاده می شود.دستگاههایی از این نوع ابتدا توسط فرانسیس استون (1919) و آرتور دمپستر (1918) با پیروی از اصول روشهایی که جی جی تامسون در 1912 ارایه کرده بود ساخته شد. اگر عنصری شامل چند نوع اتم با جرمهای متفاوت (ایزوتوپها ) باشد، این تفاوت در مقادیر یونهای مثبت حاصل از این اتمها پدیدار می گردد.طیف نگار جرمی یونها را بر حسب مقادیر نسبت بار به جرم ، از یکدیگر جدا می کند، و سبب می شود که یونهای مثبت متفاوت در محلهای مختلف روی یک صفحه عکاسی اثر کند.
وقتی دستگاه کار می کند، اتمهای بخار ماده مورد مطالعه در معرض بمباران الکترونی قرار گرفته و به یونهای مثبت تبدیل می شوند.این یونها بر اثر عبور از یک میدان الکتریکی ، به قدرت چندین هزار ولت ، شتاب پیدا می کنند. اگر ولتاژ این میدان ثابت نگه داشته شود، تمام یونهایی که مقدار بار به جرم مساوی دارند، با سرعت مساوی وارد یک میدان مغناطیسی می شوند. این سرعت، مقدار بار به جرم و شدت میدا مغناطیسی، شعاع مسیر یون را در میدان مغناطیسی تعیین می کند.
اگر شدت میدان مغناطیسی و ولتاژ شتاب دهنده ثابت نگه داشته شوند، تمام یونهایی که مقدار بار به جرم مساوی دارند، در یک محل بر روی صفحه عکاسی متمرکز می شوند. این محل را می توان با تغییر پتانسیلی که موجب شتاب یونها می شود، تغییر داد. ولی یونهایی که مقدار بار به جرم متفاوت دارند در محلهای مختلف روی صفحه عکاسی متمرکز می شوند. هر گاه یک وسیله الکتریکی که شدت اشعه یونی را اندازه می گیرد، جای گزین صفحه عکاسی شود، دستگاه را طیف سنج جرمی می نامیم. با استفاده از طیف سنج جرمی می توان هم جرم اتمی دقیق ایزوتوپها و هم ترکیب ایزوتوپی عناصر (انواع ایزوتوپهای موجود و مقدار نسبی هر یک) را تعیین کرد.
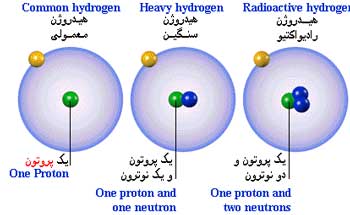
ایزوتوپها، اتمهایی با عدد اتمی مساوی و عدد جرمی متفاوتند. این اتمها دارای خواص شیمیایی بسیار مشابه هم (در اغلب موارد غیر قابل تشخیص) هستند. مثلا در طبیعت دو نوع اتم کلر وجود داردکه هر دو 17 پروتون و 17 الکترون دارند ولی یکی دارای 18 نوترون و دیگری دارای 20 نوترون است. بنابراین، اختلاف ایزوتوپها در تعداد نوترونهای هسته ها آنهاست. بعضی از عناصر فقط به یک شکل ایزوتوپی در طبیعت وجود دارند(مثل سدیم، بریلیم و فلویور). ولی اغلب عناصر بیش از یک ایزوتوپ دارند.مثلا قلع دارای ده ایزوتوپ است. اصطلاح نوکلید، به طور کلی، برای گونه های اتمی به کار می رود.
بسیاری از ایزوتوپها از ایزوتوپها رادیواکتیو هستن ، یعنی ذراتی با فرکانس بالا را از هسته (مرکز) اتمهای خود را ساطع می کنند . از آنها می توان برای دنبال کردن مسیر مواد متحرکی که از دید پنهان هستند ، مانند جریان خون در بدن یک بیمار در بیمارستان ، استفاده کرد.
جریان خون
مقدار کمی از یک ایزوتوپ رادیو اکتیو به درون جریان خون بیمار تزریق می شود . سپس مسیر آن توسط آشکارسازهای خاصی که فعالیت رادیواکتیویته را مشخص می کنند دنبال می شود . این اطلاعات به یک کامپیوتر داده می شود ، که صفحه آن هر گونه اختلالی ، مانند انعقاد خون در رگها ، را نشان می دهد . با استفاده از روشی مشابه ، می توان از ایزوتوپها برای مطالعه جریان مایعات در تاسیسات شیمیایی نیز استفاده کرد.
فرسودگی ماشین آلات
آهنگ فرسودگی ماشین آلات صنعتی را نیز می توان با استفاده از ایزوتوپها اندازه گرفت . مقادیر اندکی از ایزوتوپهای رادیواکتیو به بخشهای فلزی ماشین آلات ، مانند یاتاقانها و رینگ وپیستونها اضافه می شود . سپس سرعت فرسودگی با اندازه گرفتن رادیواکتیویته روغنی که برای روغنکاری این بخشها به کار رفته است محاسبه می شود.
منبع: http://www.academist.ir/?p=99
شیمی
هدف :
شیمی علم اتمها، پیوندها و مولکولهاست. دانشی که میتواند خواص ماده، چگونگی تغییرات و شیوه تولید آنها را از هسته اتم گرفته تا کهکشانها بررسی کند و رشته شیمی، رشتهای است که به پرورش متخصصانی میپردازد که با مطالعه و تحقیق و آزمایش به ابداع و نوآوری پرداخته و یا فرآوردههای شیمیایی را کنترل میکنند.
دکتر محمدحسین رفیعی استاد شیمی دانشگاه تهران در معرفی این رشته میگوید:
«رشته شیمی دارای دو بخش علم شیمی و صنایع شیمی است که علم شیمی به عنوان یکی از علوم پایه زیربنای علوم مختلفی همچون بیولوژی ، بیوتکنولوژی ، پزشکی ، دندانپزشکی ، داروسازی و رشتههای متعدد مهندسی است. اما صنایع شیمیایی عبارت است از صنایعی که در آنها واکنش شیمیایی انجام میگیرد یعنی اقسام مواد اولیه تبدیل به محصولات جدید میگردد که خواص این محصولات تا حدودی با مواد اولیه متفاوت است.»
وی در ادامه میگوید:
«با توجه به تعریف فوق صنایع شیمی طیف گستردهای از صنایع را در بر میگیرد که از آن جمله میتوان به صنایع غذایی، داروسازی، پتروشیمی ، الیاف مصنوعی ، بهداشتی و آرایشی و صنایع تولید لوازم خانگی اشاره کرد.»
یکی دیگر از اساتید دانشگاه در معرفی این رشته میگوید:
«بررسی و مطالعه اجمالی ترکیب، ساختار و ویژگیهای ماده و همچنین کنترل آزمایشگاهی فرآیندهای شیمیایی، مطالب و فعالیتهایی است که در رشته شیمی در سطح کارشناسی ارایه میگردد. در سطح کارشناسی ارشد و دکترا نیز دانشجویان در گرایشهای تخصصی این رشته که عبارتند از : شیمی آلی ، شیمی تجزیه ، شیمی معدنی ، شیمی فیزیک و شیمی کاربردی به صورت عمیقتری با بخشی از علم شیمی آشنا میگردند تا در آینده بتوانند مرزهای دانش شیمی را گسترش دهند.»
تواناییهای فارغالتحصیلان
فارغالتحصیلان این دوره میتوانند مسؤولیت زمینههای مختلف از جمله موارد زیر را عهدهدار باشند:
1- طرح، نظارت و اجرای طرحهای تحقیقاتی کوچک و بزرگ شیمیایی در سطوح مختلف کاربردی و علمی محض، در دانشگاهها، کارخانجات و مراکز تحقیقاتی ، به منظور ارتقای کمی و کیفی محصولات مورد نیاز جامعه .
2- مسوولیت و ارایه خدمات در آزمایشگاههای کنترل کیفی، پیگیری و ارایه معیارهای استاندارد به منظور افزایش کمیت و کیفیت محصولات تولیدی و همچنین مواد مصرفی کارخانهها و صنایع .
3- ارایه خدمات آموزشی در سطح دانشگاهها ، دبیرستانها و موسسات آموزشی.
4- ارایه طرحهای پژوهشی به منظور استفاده از منابع اولیه ارزنده موجود در جامعه در جهت افزایش بهرهوری از آنها و جلوگیری از صادرات بیرویه مواد اولیه ارزشمند و تبدیل آنها به محصولات واسطهای که ارزش اقتصادی بالاتری دارند.
5- ارایه خدمات در کارخانجات پتروشیمی ، پلاستیک ، لاستیک ، رنگ و رزین ، الیاف ، صنایع غذایی ، صنایع دارویی، بهداشتی و شویندهها .
6- آمادگی برای ادامه تحصیلات در مقاطع بالاتر برای تامین کادر علمی دانشگاهها و سایر مراکز علمی.
7- کمک به توسعه صنایع دستی که در سطح گستردهای در جامعه پراکنده هستند؛ از جمله ساخت رنگهای بهتر و متنوعتر، بخصوص استفاده از رنگهای طبیعی موجود در صنعت فرش.
8- استفاده از گیاهان دارویی فراوانی که در مملکت موجودند، به منظور استخراج و شناسایی موارد کاربرد این گیاهان به کمک متخصصان داروساز.
هدف از این دوره تربیت کارشناسانی است که در زمینههای آموزش در دبیرستان، تربیت کمک پژوهشگر، آماده کردن دانشجویان برای ورودبه دورههای کارشناسی ارشد و دکتری به منظور تامین کادر آموزشی، پژوهشی مورد نیاز دانشگاهها و موسسات تحقیقاتی ، کارشناسان مورد نیاز صنایع شیمیایی و بینیازی از کارشناسان خارجی بتوانند از عهده برآیند. دوره دارای دو گرایش: شیمی محض ، شیمی کاربردی است. داوطلب باید در دروس شیمی، فیزیک و ریاضی دبیرستان قوی بوده ، علاقه ، انگیزه و روحیه کاوشگری لازم را دارا باشد. دروس به صورت عمومی ، پایه ، الزامی (مشترک بین دو گرایش ) و اختصاصی ارایه میشود. بعضی دروس الزامی عبارت است از : شیمی آلی ، شیمی تجزیه، شیمی فیزیک، شیمی معدنی، معادلات دیفرانسیل. علاوه بر این دروس 32 واحد درسی در هر گرایش وجود دارد. در شاخه شیمی محض و شیمی کاربردی 20 واحد از این 32 واحد انتخابی است.
بعضی تواناییهای فارغالتحصیلان به شرح زیر است:
عهدهدار شدن مسوولیت هدایت آزمایشگاهها و کمک به امر تدریس شیمی در دانشگاهها ، همکاری در زمینههای پژوهشی در موسسات ذیربط و دانشگاهها، سرپرستی آزمایشگاههای کنترل کیفیت مواد اولیه و محصولات در صنایع شیمیایی و رفع مشکلات شیمیایی صنایع موجود ، ارایه روشهای بهتر جهت بالا بردن سطح تولید از نظر کیفی و کمی.
با توجه به نیاز دانشگاهها به مدرس شیمی، نیاز صنایع مختلف شیمیایی به پژوهشگر و کمبود متخصص ایرانی برای اداره کنترل کیفیت آزمایشگاههای شیمی صنایع موجود، اهمیت این رشته مشخص میشود.
امکان ادامه تحصیل در این رشته تا حد دکتری در داخل و خارج از کشور وجود دارد. برخی از مراکز جذب کارشناسهای شیمی به شرح زیر است:
وزارتخانههای آموزش و پرورش ، صنایع سنگین ، صنایع و معادن ، فرهنگ و آموزش عالی ، کشاورزی ، نفت و نیز آموزشگاههای شیمی، صنایع شیمیایی و نظایر آنها .
نظر دانشجویان : رشته شیمی از لحاظ محتوا بسیار گسترده و با اکثر صنایع به نحوی مرتبط است، به همین دلایل زمینههای پژوهش و استخدام بسیار وسیع است.
گرایشهای مقطع لیسانس:
رشته شیمی در مقطع کارشناسی دارای دو گرایش «محض و کاربردی» میباشد.
محض و کاربردی عنوان گرایشهای بعضی از رشتههای دانشگاهی مثل شیمی و ریاضی است اما این دو گرایش چه تفاوتی با یکدیگر دارند؟
دکتر جمشید مفیدی استاد شیمی دانشگاه تهران در معرفی این دو گرایش میگوید:
«در گرایش محض مبنای کار علم شیمی است و دانشجو درباره چهار گرایش اصلی علم شیمی که عبارتنداز : شیمی آلی ، معدنی ، تجزینه و شیمی فیزیک دروسی را مطالعه میکند. اما در شیمی کاربردی، دروس پایه شیمی کمتر مطالعه میشود و دانشجو یکسری از دروس مربوط به مهندسی شیمی مثل اصول صنایع شیمیایی و تصفیه آب و فاضلاب را میگذراند.»
دکتر مفیدی در مورد موقعیت شغلی فارغالتحصیلان این دو گرایش میگوید:
« فارغالتحصیل شیمی محض در شروع یک فعالیت صنعتی نقش دارد چرا که او راهکارهای تیوریک ساخت یک ماده را ارایه میدهد و سپس یک فارغالتحصیل شیمی کاربردی و یا مهندس شیمی طراحی نیمه صنعتی ماده مورد نظر را ارایه میدهد.»
دکتر پرویز رنجبر رشیدی استاد شیمی دانشگاه تهران نیز در معرفی این دو گرایش میگوید:
«تفاوت این دو گرایش در نحوه نگرش آنها به علم شیمی است چون شیمی کاربردی نگرشی کاربردی به علم شیمی دارد و میخواهد از آموختههای شیمی در صنعت استفاده کند و به همین دلیل فارغالتصیلان این گرایش با مفاهیمی که در صنایع شیمی مطرح است آشنایی بیشتری داشته و بهتر جذب بازار کار میشوند اما هدف شیمی محض پرورش دانشجویانی است که کارهای تحقیقاتی انجام بدهند و با تحصیل در دوره فوقلیسانس و دکترا به حل مسایل و ناشناختههای علمی شیمی بپردازند. از همینرو درسهای نظری گرایش شیمی محض بیشتر از دروس کاربردی آن است.»
امید خاکشور دانشجوی کارشناسی ارشد شیمی دانشگاه صنعتی شریف نیز ضمن معرفی این دو گرایش میگوید:
«هرچند که شیمی محض بیشتر به تیوریهای عمیقتر شیمی میپردازد و شیمی کاربردی با ارایه یکسری واحدهای کاربردی، ارتباط نزدیکتری با صنعت دارد ، اما این دو گرایش در سطح لیسانس فرق زیادی با یکدیگر ندارند و اگر کسی مایل باشد از هر دو گرایش اطلاع داشته باشد، میتواند در دروس اختیاری ، بعضی از واحدهای اختصاصی گرایش دیگر را انتخاب کند. البته واقعیت این است که فارغالتحصیلان شیمی کاربردی راحتتر جذب بازار کار میشوند که آن هم بیشتر به خاطر عنوان این گرایش است تا معلومات فارغالتحصیلان آن!»
آینده شغلی ، بازار کار ، درآمد:
دکتر رفیعی در انتها میگوید:
«البته باید گفت این طور نیست که هیچ فرصت شغلی برای فارغالتحصیلان این رشته مهیا نباشد چون تعدادی از فارغالتحصیلان شیمی جذب صنایع شیمیایی مختلف مثل صنایع رنگسازی، چرمسازی، پتروشیمی ، موادغذایی، لوازم بهداشتی و آرایشی میشوند و در بخش آزمایشگاههای کنترل کیفیت محصولات شیمیایی و یا واحد تولید آنها کار میکنند.»
دکتر جمشید مفیدی نیز در مورد فرصتهای شغلی فارغالتحصیلان این رشته میگوید:
«من فکر میکنم که شیمی جزو معدود رشتههایی است که فارغالتحصیل آن میتواند همیشه مشغول به کار باشد. چون هر کارخانهای که دایر شود، در بخش کنترل کیفیت کالاهای ساخته شده نیاز به یک شیمیست دارد و یا در تمام صنایع احتیاج به فارغالتحصیلان شیمی داریم تا مواد اولیه را با توجه به استانداردهای جهانی بررسی کرده و رد یا قبول بکنند.
علاوه بر موارد فوق یک شیمیست میتواند در خانه خود با کمترین امکانات کارگاه کوچکی دایر کرده و بعضی از مواد مورد نیاز جامعه را تولید کند برای مثال من فردی را میشناسم که بعضی از مواد مورد نیاز وزارت دفاع را در یک کارگاه کوچک تهیه میکرد.»
دکتر پرویز رنجبر رشیدی نیز در همین زمینه میگوید:
«فارغالتحصیلان این رشته توانایی تغییر و تبدیل بر روی مواد خام را دارند و به یاری همین توانایی، تعداد زیادی از فارغالتحصیلان این رشته کارگاهها یا کارخانههای شیمیایی کوچک یا بزرگ دایر کرده و در کار خود نیز موفق بودهاند.
در ضمن فارغالتحصیل شیمی میتواند در کارگاهها و کارخانههای تهیه مواد آلی، دارویی ،رنگها ، رزینها و تهیه و ترخیص مواد معدنی کار بکند. »
ظرفیت پذیرش کل و گرایش مختلف :
طی سه سال تحصیلی 76 تا 78 بطور متوسط در هر سال 446 نفر دانشجو از گره آزمایشی علوم ریاضی و فنی و 2772 نفر از گروه علوم تجربی در رشته شیمی پذیرفته شدهاند.
تواناییهای مورد نیاز و قابل توصیه
شیمی یعنی حفظ کردن صدها فرمول، عدد و رقم . این تصور بسیاری از دانشآموزان دبیرستانی است . تصوری که به اعتقاد دکتر جمشید مفیدی از دبیرستانها نشأت میگیرد چرا که حجم مطالب کتاب شیمی دبیرستانی زیاد و فرصت تدریس محدود است و به ناچار دبیران و محصلان به جای درک و استدلال مفاهیم، به سوی مسایل ذهنی و حفظی کشیده میشوند. در حالی که شیمی تلفیقی از مهارتهای ذهنی و استدلالی است و اگر کسی بخواهد در این رشته موفق گردد باید در هر دو زمینه توانمند باشد و حتی میتوان گفت که قدرت استدلال بیش از قدرت حافظه در این رشته اهمیت دارد چون حافظه فقط میتواند به کار سرعت بدهد اما حلال مشکلات نیست.
وی همچنین معتقد است که دانشجوی این رشته لازم است در دروس ریاضی، شیمی و فیزیک قوی باشد و رشته شیمی را دوست بدارد یعنی از مطالعه درس شیمی لذت ببرد و خسته نشود.
«دانشجوی شیمی باید به شیمی علاقهمند باشد نه این که رشته شیمی در فرم انتخاب رشته، انتخاب چهلم و پنجاهم او باشد. همچنین دانشجو باید مثل مارگیرهای قدیمی که مار را میگرفتند و از آن استفاده بهینه میکردند، شجاع بوده و وسواس نداشته باشد چون بعضی از مواد شیمیایی مثل مار خطرناکند اما اگر کسی طرز استفاده از همین مواد را بلد باشد، موادی قابل کنترل و بسیار مفید هستند.»
وضعیت ادامه تحصیل در مقاطع بالاتر :
رشته شیمی در ایران تا مقطع دکترا تدریس میشود.
دوره کارشناسی ارشد شیمی دورهای با گرایشهای تخصصی در پنج گرایش (شیمی آلی ، شیمی تجزیه ، شیمی معدنی ، شیمی فیزیک ، شیمی کاربردی ) است.
دوه دکترای شیمی نیز پس از دوره کارشناسی ارشد در دو بخش «آموزشی و پژوهشی» ارایه میگردد.
رشتههای مشابه و نزدیک به این رشته :
این رشته دارای واحدهای مشابه با رشته مهندسی شیمی میباشد.
وضعیت نیاز کشور به این رشته در حال حاضر:
شهرام سعادت دانشجوی این رشته نیز با اشاره به اشتغالزایی این رشته میگوید:
«شیمی رشتهای است که هم برای فارغالتحصیلان شیمی و هم برای افراد مختلف جامعه فرصت شغلی ایجاد میکند. برای مثال با ایجاد هر شغل در صنعت پتروشیمی حدود بیست شغل در صنایع پایین دستی و وابسته به وجود میآید.»
دکتر رفیعی در تایید این سخن میگوید:
«تنها کافی است وضعیت واردات کشور خودمان را بررسی کنیم تا به واقعیت سخن لینوس پاولینگ پی ببریم. چون درحال حاضر کشور ما هر ساله حدود 5 میلیارد دلار صرف خرید 3500 کالای شیمیایی میکند. یعنی ما یک کیلو نفت را 10 سنت میفروشیم آن وقت یک کیلو از مواد شیمیایی را 40 هزار ، 50 هزار و حتی بعضی از داروهای شیمیایی را تا 100 هزار دلار خریداری میکنیم .
این در حالی است که کشور ما به دلیل داشتن هیدرو کربنها، منابع معدنی و همچنین نیروی انسانی متخصص میتواند کالاهای شیمیایی بسیاری را تولید کند. کاری که چین انجام داد و توانست با کمترین امکانات ، بازار کالاهای شیمیایی دنیا را قبضه کند. »
وی در ادامه میگوید:
«در ضمن باید توجه داشت که خرید کالاهای شیمیایی نه تنها به بودجه کشور فشار سنگینی وارد میکند بلکه فرصتهای شغلی صدها فارغالتحصیل رشته شیمی را نیز از بین میبرد. افرادی که باید با استفاده از منابع اولیه کشور به تولید کالاهای شیمیایی بپردازند. »
نکات تکمیلی :
رشته شیمی از جمله رشتههایی است که داوطلبان دو گروه آزمایشی علوم ریاضی و فنی و علوم تجربی میتوانند آن را انتخاب کنند. البته مواد امتحانی و ضرایب این رشته در هر گروه آزمایشی متفاوت است و دانشگاهها نیز برای داوطلبان هر گروه ظرفیت پذیرش ویژهای در نظر گرفتهاند.
استخراج کافئین از چای:
روش انجام آزمایش:
1 – یک بشر 500 یا 1000 میلی لیتری را بردارید.
2 – حدود 15 گرم چای خشک راوزن کرده و در بشر بریزید. وزن دقیق چای را یادداشت کنید.
3- مقدار 300 میلی لیتر آب مقطر را به بشر اضافه کنید.
4 - محتویات بشر را حدود 15 الی 20 دقیقه بجوشانید و چند بار هم بزنید.
5 – پس از اتمام مدت زمان لازم برای جوشیدن، تفاله های چای را کاملا از محلول جدا کرده و 15دقیقه آنرا به حال خود بگذارید تا محلول سرد شود.
6 - محلول حاصل را به داخل یک قیف دکانتور 500 میلی لیتری بریزید. سپس به آن 100 میلی لیتر کلروفرم (زیر هود) اضافه کنید و درب قیف راببندید و به آرامی قیف را سروته کنید. برای خروج گاز از داخل قیف باید شیر دکانتور رو بالا باشد و قسمت پایین دکانتور را بادست نگهدارید تا احیانا درب آن نیفتد و محلول بیرون نریزد.
7 – اجازه دهید تا کلروفرم در ته قیف ساکن شود. وقتی محلول داخل قیف دو فازی شد، محلول پایینی که همان کلروفرم است(که البته کافئین را در خود حل کرده) را با دقت در داخل یک بشر س خالی کنید.
برای تبخیر حلال میتوانید از دستگاه روتاری استفاده کنید. اگر چنین دستگاهی ندارید به روش زیر عمل کنید:
8 - در زیر هود یک حمام آب جوش آماده کرده و ظرف حاوی محلول را در داخل آن قرار دهید. دمای جوش کلروفرم 61 تا 62 درجه سانتیگراد است. محلول آنقدر در حمام بماند تا حجم آن به 20 میلی لیتر برسد.
9 – یک ساعت شیشه تمیز را به دقت وزن کرده و عدد آنرا یادداشت کنید.
10 - ساعت شیشه را بالای حمام قرار داده و در داخل آن از محلول پر کنید و حلال آنرا را تبخیر کنید.این کار را ادامه دهید تا تمام کافئین از محلول جدا گردد.
11 – ساعت شیشه را از روی حمام آب بردارید و ته آنرا خشک کنید و بگذارید تا سرد شود. سپس آنرا وزن کنید و مقدار کافئین را بدست آورید.
برای تعیین درصدکافئین در چای کافیست تا وزن کافئین را بر وزن چای تقسیم کرده و حاصل را در 100 ضرب کنید.
با سلام خدمت دوستان عزیز
آدر س داده شده زیر یک فایل در مورد آزمایشگاه شیمی بصورت ورد می باشد که لغات کلیدی آن
shimiye omoomi
می باشد و در یاهو گوگل نیز می توانید به آن دست یابید.
http://applicationmobile.diinoweb.com/files/Tahghigh/Shimi/Shimiye%20omoomi%202.doc
عناوین یادداشتهای وبلاگ