اطلاعات اولیه
پلوتونیوم ، یک
عنصر شیمیایی رادیواکتیو و
فلزی است که نماد آن
Pu و
عدد اتمی آن 94 میباشد.
وزن اتمی این عنصر 244.06 بوده ،
چگالی آن 19.800 kg/m
3 میباشد. پلوتونیوم در سال 1940 توسط
GlennT.Seaborg ،
Edwin McMillan ،
Kennedy و
Wahl از طریق بمباران دوترونی اورانیوم در سیکلوترون (شتاب دهنده ذرات مدور) Berkeley Radiation Laboratory دانشگاه کالیفرنیا برکلی کشف شد. اما این کشف تا مدتها سری باقی ماند. این عنصر با توجه به کشف سیاره پلوتو که درست بعد از
نپتون کشف شد، پلوتونیوم نام گرفت؛ (پلوتون در منظومه شمسی بعد از نپتون قرار دارد).
ایزوتوپها
مهمترین
ایزوتوپ پلوتونیوم Pu239 بوده که
نیم عمر آن 24200 سال میباشد و بدلیل نیمه عمر کوتاه آن ، رد بسیار ناچیزی از پولوتونیم بهصورت طبیعی در معادن
یافت میشود. پلوتونیوم 239 ، در رآکتورهای هستهای از اورانیوم 238 و در مقیاسهای بالا تولید میشود.
ایزوتوپ پلوتونیوم 238 ساطع کننده
اشعه آلفا میباشد که نیمه عمرش 87 سال است. این خصوصیات ، آن را برای استفاده در تولید نیروی برق برای دستگاههایی که میبایست بدون نگهداری مستقیم در مقیاسهای زمانی حدودا برابر عمر انسان کار کنند، مناسب میکند؛ بنابراین در RTG هائی مانند آنهائی که نیروی کاوشگرهای فضایی Galileo و Cassini را تامین میکنند، کاربرد دارد.
همچنین پلوتونیم چهار ظرفیت یونی را در محلولهای آبی از خود نشان میدهد
یون
+PuO در محلولهای آبی پایدار نیست و تناسبی با
4+Pu و
2+PuO ندارد.
4+Pu میتواند
+PuO را به
2+PuO تبدیل کرده ، خودش به
3+PuO تبدیل شود و یک
+PuO و
3+PuO آزاد کند.
پلوتونیوم ترکیبات دوتایی PuO و PuO
2 را با
اکسیژن شکل میدهد و با هیدراتهای PuF3,PuF4,PuCl3,PuBr3,PuI3 و
کربن ،
نیتروژن و
سیلیکون در ترکیبات متغیر مداخله میکند. Puc, PuN, PuSi
2 و اکسی هالیدها نیز شناخته شده میباشند: PuOCL , PuObr , PuOI.
کاربردها
پلوتونیوم یکی از مواد مهم
شکافت هستهای در
سلاحهای هستهای پیشرفته میباشد. باید احتیاط لازم جهت جلوگیری از جمع شدن مقداری از پلوتونیوم که به جرم بحرانی نزدیک میشود، به عمل آورد، چرا که این مقدار از پلوتونیوم خود به خود
واکنشهای شیمیایی تولید میکند.
بدون توجه به محدود نشدن پلوتونیوم توسط فشار خارجی که برای یک سلاح هستهای لازم است، پلوتونیوم میتواند خودش را گرم کرده ، هر چیزی را که پیرامون آن را محدود میکند بشکند، جلوگیری شود. شکل ظاهری پلوتونیوم هم در این امر موثر است، بنابراین ، باید از اشکال فشرده مانند کره جلوگیری کرد.
همچنین پلوتونیوم مخصوصا نوع بسیار خالص آن ، آتشزا بدوه ، بهصورت شیمیایی با
اکسیژن و
آب واکنش میدهد که میتواند باعث انباشتگی هیدرید پلوتونیوم و یک ترکیب Pyrophoric شود که ماده ای است که در دمای اطاق در هوا میسوزد. حجم پلوتونیوم به هنگام ترکیب شدن با اکسیژن بسیار افزایش مییابد و میتواند ظرف خود را بشکند. بنابر این احتیاطهای لازم برای حمل پلوتونیوم در هر شکل آن ، باید انجام شود و عموما یک اتمسفر خشک و خنثی نیاز میباشد.
علاوه بر اینها ، خطرات
رادیواکتیوی نیز وجود دارد. خاک اکسید منیزیم موثرترین ماده برای فرو نشاندن آتش پلوتونیوم میباشد. آن ماده ، شعله را مانند یک کاهنده دما ( Hit Sink )سرد میکند و در عین حال از رسیدن اکسیژن به آن جلوگیری میکند. آب نیز در این مورد موثر است. در سال 1962 در
Rocky Flats Plant در نزدیکی Boulder, Colorado یک آتشسوزی بزرگ پلوتونیومی رخ داد.
پلوتونیوم همچنین در ساخت سلاحهای رادیولوژیکی و ساخت زهرها ( نه الزاما مهلک ) کاربرد دارد. تودههای انباشته شده پلوتونیوم توسط اتحاد جماهیر شوروی قدیم و ایالات متحده آمریکا بوجود میآمد. از پایان جنگ سرد ، تمرکز بر نگرانی از گسترش تکنولوژی هستهای بوجود آمد. در سال 2002 دپارتمان انرژی ایالات متحده 34 تن از مواد پلوتونیوم را که برای ساخت سلاحهای هستهای استفاده میشد، از دپارتمان دفاع ایالات متحده گرفت و از اوایل سال 2003 تصمیم گرفت برای خلاصی از این اورانیومها ، به تبدیل چندین نیروگاه هستهای در آمریکا ، از سوخت
اورانیوم غنی شده به سوخت MOX اقدام کند.
 |
|
پلوتونیوم |
خطرات
گاهی اوقات از پلوتونیوم با عنوان سمیترین
ماده شناخته شده بر انسان نام برده میشود و این در حالی است که یک توافق کلی در میان کارشناسان مبنی بر نادرست بودن این مطلب وجود دارد. تا سال 2003 تنها یک مورد مرگ انسان بهعلت مجاورت و ارتباط با پلوتونیوم وجود داشته است. رادیومی که بهصورت طبیعی بوجود میآید، حدودا 200 برابر سمیتر از پلوتونیوم است و برخی از Toxinهای
آلی مانند سم بوتولین ، میلیاردها برابر سمیتر از پلوتونیوم میباشند.
به هر حال ،حوادث بحرانی نیز وجود داشته است. حمل بی ملاحظه 6.2 kg پلوتونیوم کروی در
Los Alamos در 21 آگوست 1945 ، باعث انتشار دوز مرگبار تشعشع گردید. "
Harry Daghlian" دوزی در حدود 510 rem دریافت کرد؛ او 4 هفته بعد درگذشت. مرگ دیگری در سال 1958 در واحد غنیسازی اورانیوم Los Alamos روی داد. پلوتونیوم در یک مخزن مخلوطکن جمع شده بود. یک بار جدید هم به آن منتقل شد و در نتیجه 8 کیلوگرم پلوتونیوم در مرکز مخزن جمع شد. یک کارگر در معرض تشعشع قرار گرفت و در کمتر از دو روز در گذشت.
حالتهای سمی پلوتونیوم از نظر شیمیایی و رادیو لوژیکی ، باید از خطرات پلوتونیوم متمایز شود. بسیاری از جنبشهای ضد هستهای و در ادامه جنبشهای سیاست سبز از پلوتونیوم بهعنوان خطرناکترین ماده شناخته شده برای بشریت یاد کردهاند و تنها دلیلشان ، نقش مهلک آن در تولید سلاحهای هستهای میباشد.
احتمالا اختلاف این دو دیدگاه است که باعث گزافهگوییهای احساسی در خصوص سمی بودن پلوتونیوم میشود. در سال 1989 نوشته ای از "
Bernard L. Cohen" اینگونه بیان می کند که:
««
خطرات پلوتونیوم خیلی آشکارتر و راحتتر از خطرات ناشی از مواد افزودنی به غذاها و همچنین حشره کشها فهمیده میشوند و در مقایسه تنها یک مرگ در هر 300 سال میتواند کممایه بودن این نظر را اثبات کند. علیرغم حقایق شناخته شده بر جامعه علمی افسانه سمی بودن پلوتونیوم همچنان ادامه دارد.»»
بنابراین هیچ گونه شک و تریدی وجود ندارد که پلوتونیوم در صورت استفاده نادرست میتواند بسیار خطرناک باشد. پرتوی
آلفا که پلوتونیوم از خود ساطع میکند نمیتواند به پوست نفوذ کند، اما میتواند به اندامهای داخلی در صورت تنفس و یا خوردن پلوتونیوم آسیب برساند. ذرات بسیار کوچک پلوتونیم در صورت تنفس و رسیدن به ریهها میتواند باعث بوجود آمدن سرطان ریه شود. مواد دیگر از جمله
ricin ، سم
botulinum و سم tetanum در دوزهائی کمتر از یک میلیگرم ، میتوانند کشنده باشند، بنابراین پلوتونیوم از این نظر غیر عادی نیست.
مقادیر قابل توجه بیشتر آن ، در صورت بلع یا تنفس ، میتواند باعث بوجود آمدن مسمومیت رادیویی حاد و مرگ شخص شود. با این وجود ، تاکنون هیچ مورد مرگ بهعلت خوردن و یا تنفس پلوتونیوم دیده نشده و بسیاری از مردم مقدار قابل توجهی پلوتونیوم در بدن خود دارند.
خصوصیات
این فلز ظاهری نقرهای رنگ دارد و هنگامی که اکسید میشود، رنگش تا حدی به زرد تیره میگراید. اگر مقدار زیادی از پلوتونیوم در جایی جمع شود، به قدری گرم میشود که نمیتوان آن را لمس کرد و دلیل آن نیز ساطع کردن انرژی آلفا میباشد. مقادیر بیشتر گرمای لازم را برای جوشاندن
آب بوجود میآورد. این فلز بهسرعت در اسید هیدرویدیک یا اسید پرکلریک غلیظ ، حل میشود. این فلز شش حالت آلوتروپی Allotropic با ساختارهای
بلورین گوناگون از خود نشان میدهد که
چگالی آنها از 16.00 تا 19.86 تغییر میکند.


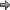 نحوه...
نحوه...