شیمی آلی فلزی شیمی ترکیب هایی است که دارای پیوند کربن فلز می باشند، این زمینه از شیمی انواع گوناگونی از ترکیبات را در بر می گیرد .این ترکیب ها عبارتند از ترکیب هایی که هم دارای پیوند (?) و هم دارای پیوند (?) بین اتم های فلز و کربن می باشند. تعداد زیادی ترکیب ها ی خوشه ای ، حاوی یک یا چند پیوند فلز- فلز را شامل می شوند . همچنین شامل مولکولهایی می شوند که ساختار غیر معمول یا ناشناخته در شیمی آلی دارند و واکنش هایی را در بر می گیرند که در بعضی موردها مشابه واکنش های شناخته شده در شیمی آلی اند . در برخی موردها ، کاملا با آن تفاوت دارند. ترکیب های آلی فلزی افزون بر خواص جالب توجه ، کاتالیزگرهایی را نیز می سازند که از نظر صنعتی بسیار مفیدند . در سالهای اخیر واکنشگر های آلی فلزی در سنتز تعداد زیادی از مولکولها ، نقش کلیدی و اساسی پیدا کرده اند . همچنین این ترکیب ها ، مولکولهایی را شامل می شوند که تعداد زیادی از آن ها دارای فعالیت های بیولوژیکی اند.
ترکیبات آلی فلزی را ممکن است صرفا به عنوان ترکیباتی که شیمی آلی فلزات را تشکیل میدهند، مشخص کرد. با وجود این ، مرزبندی بین ترکیبات آلی فلزی و شیمی آلی فلزی واضح و روشن نیست. هر شیمیدانی ، نیکل تترا کربونیل 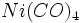 را بهعنوان یک ترکیب آلی فلزی شناسایی و مشخص میکند. با وجود این به سختی میتوان منوکسید کربن را نوعا یک ترکیب آلی قلمداد کرد. به همین ترتیب ، ترکیبات آلی فسفر ، آلی گوگرد و آلی سلنیوم در مرز شیمی آلی فلزی قرار میگیرند، با این که فسفر ، گوگرد و سلنیوم جزء غیرفلزات مرزی هستند.
را بهعنوان یک ترکیب آلی فلزی شناسایی و مشخص میکند. با وجود این به سختی میتوان منوکسید کربن را نوعا یک ترکیب آلی قلمداد کرد. به همین ترتیب ، ترکیبات آلی فسفر ، آلی گوگرد و آلی سلنیوم در مرز شیمی آلی فلزی قرار میگیرند، با این که فسفر ، گوگرد و سلنیوم جزء غیرفلزات مرزی هستند.
شیمی آلی فلزی مهم و ادراک بهتری از پیوند ، ساختار و واکنش پذیری مولکولها بدست میدهد که پارهای از آنها منحصر به شیمی آلی فلزی است. از نظر عملی ، کاتالیزورهای آلی فلزی در عصری که لازم است در فرآیندهای شیمیایی دما و در نتیجه سوخت را به حداقل برسانیم، بطور فزایندهای اهمیت پیدا میکند.
در زمان ورنر ، نظریه والانس آن قدر پیشرفت نکرده بود که وی بتواند درباره ماهیت پیوند در ترکیباتی که مطالعه میکرد، خیلی اظهار نظر کند. با این حال ، کوشش وی در تمییز بین گروههای یونش پذیر و یونش ناپذیر (مثلا 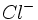 ) راه را برای پیدایش تشکیل پیوند براساس پیوند یونی در مقابل پیوند کووالانسی باز کرد. نخستین کوشش در زمینه توجیه پیوند در کمپلکسها توسط سیجویک به عمل آمد. وی نظریه هشت تایی لوویس را به ترکیبات کئوردینانس تعمیم داد.
) راه را برای پیدایش تشکیل پیوند براساس پیوند یونی در مقابل پیوند کووالانسی باز کرد. نخستین کوشش در زمینه توجیه پیوند در کمپلکسها توسط سیجویک به عمل آمد. وی نظریه هشت تایی لوویس را به ترکیبات کئوردینانس تعمیم داد.
او چنین در نظر گرفت که لیگاندها باز لوییساند و به یون فلز که به صورت اسید لوییس عمل میکند، الکترون (معمولا به ازای هر لیگاند یک زوج الکترون) نمیدهند. فرض شد که پایداری این ترکیبات به آرایش الکترونی گاز نجیب وابسته باشد. مجموع الکترونهای فلز به اضافه الکترونهای داده شده بوسیله لیگاندها ، عدد اتمی موثر (EAN) نامیده شد و وقتی این عدد Kr)36 ، (Xe)54) یا Rn)86) بود، گفته میشد که از قاعده EAN تبعیت شده است. به بیان دیگر ، میتوان گفت که وقتی آرایش الکترونی به صورت 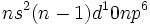 است، 18 الکترون در این اوربیتالهای والانس حضور دارند که یک آرایش الکترونی بسته را تشکیل می دهند.
است، 18 الکترون در این اوربیتالهای والانس حضور دارند که یک آرایش الکترونی بسته را تشکیل می دهند.
در واقع از این قاعده تقریبی بیش از پیش به عنوان قاعده 18 الکترون یاد می شود و مزیت آن این است که برای ردیفهای جدول تناوبی یکسان است و الزامی ندارد که برای هر گاز نجیب به EAN متفاوتی اشاره کنیم. علاوه بر این ، به خاطر سپردن این عدد آسان است، چون صرفا به ظرفیت 9 اوربیتال ، مجموعه ای از یک اوربیتال S ، سه اوربیتال P و پنج اوربیتال d تشکیل می شود، اشاره دارد.
تعداد ترکیبات آلی فلزی بخصوص کربونیلها و نیتروزیلهای فلزی که از این قاعده تبعیت میکنند، نسبتا زیاد است و زمانی بکار میآید که برای عضوی از این گروههای ترکیبات آلی فلزی که از آن تبعیت میکنند، بکار برده شود.
چیزی که مانع بررسی کمی اوربیتالهای مولکولی در کربونیلها میشود، نداشتن معلومات در مورد انرژیهای نسبی اوربیتالهای گوناگون میباشد. با وجود این ، میتوانیم ملاحظه کنیم که در تمام کمپلکسهای کربونیل و تا حد کمتری در سایر ترکیبات آلی فلزی سیستم ( پیوندی سیگما ) قوی که توسط اثر بده و بستانی سیستم ( پیوندی پی ) تقویت شده است، منجر به جدایی شدید اوربیتالهای پیوندی و ضد پیوندی میشود. در این صورت فقط یک آرایش با پایداری ماکسیمم وجود دارد که آن هم معمولا مربوط به یک مجموعه هجده الکترونی است.
تقریبا کلیه فلزات واسطه ، ترکیباتی میدهند که آنها کربن منوکسید بهصورت لیگاند عمل میکند. در مورد این ترکیبات سه نکته قابل توجه است:
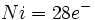 |
 |
 |
 |
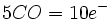 |
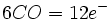 |
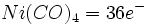 |
 |
 |
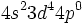 نوشت و وقتی به این شش الکترون ، شش زوج الکترون که بوسیله گروههای کربن منوکسید تامین میشوند، اضافه گردد جمعا 18 الکترون (6+12=18) خواهیم داشت. پس تنها با شمارش الکترونها در اوربیتالهای 3d ، 4s و 4p داریم:
نوشت و وقتی به این شش الکترون ، شش زوج الکترون که بوسیله گروههای کربن منوکسید تامین میشوند، اضافه گردد جمعا 18 الکترون (6+12=18) خواهیم داشت. پس تنها با شمارش الکترونها در اوربیتالهای 3d ، 4s و 4p داریم: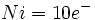 |
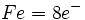 |
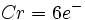 |
 |
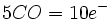 |
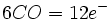 |
 |
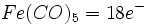 |
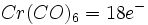 |
در فلزاتی که عدد اتمی آنها فرد است، قاعده 18 الکترون صرفا بوسیله افزایش لیگاندهای کربن منوکسید برآورده نمیشود؛ زیرا تعداد الکترونهای جزء حاصل ، صرفنظر از اینکه چه تعداد کربونیل اضافه شده باشد، فرد خواهد بود ( و بنابراین تعداد الکترونها مساوی 18 نمیشود ). در این فلزات قاعده 18 الکترون به چند طریق برآورده میشود. سادهترین آنها افزودن یک الکترون بوسیله عامل کاهنده است که یک آنیون مثل 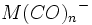 تشکیل میدهد. بطریق دیگر ، آن جزء که دارای کمبود الکترون است می تواند بطور کوالانسی با اتم یا گروهی مثل هیدروژن یا کلر که آن نیز یک الکترون جفت نشده دارد، تشکیل پیوند بدهد:
تشکیل میدهد. بطریق دیگر ، آن جزء که دارای کمبود الکترون است می تواند بطور کوالانسی با اتم یا گروهی مثل هیدروژن یا کلر که آن نیز یک الکترون جفت نشده دارد، تشکیل پیوند بدهد: 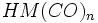 یا
یا 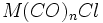 . سرانجام چنانچه گونه دیگری موجود نباشد که جزء فلز کربونیل با آن ترکیب شود، دو جزء فلز کربونیل هر کدام با یک الکترون فرد میتوانند از طریق به اشتراک گذاشتن این الکترونها بهصورت دیمر در آیند.
. سرانجام چنانچه گونه دیگری موجود نباشد که جزء فلز کربونیل با آن ترکیب شود، دو جزء فلز کربونیل هر کدام با یک الکترون فرد میتوانند از طریق به اشتراک گذاشتن این الکترونها بهصورت دیمر در آیند.
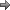 نحوه...
نحوه...
عناوین یادداشتهای وبلاگ