اندازه گیری میزان سختی آب :
به طورکلی دونوع سختی داریم : 1- دایم 2- موقت
وقتی که یونهایی مثل درآب حل شده باشداین آب دارای سختی است .
باعث می شودکه PH آب باران پایین آمده و آب خاصیت اسیدی پیداکند . که باحرارت دادن می توان یونهای فوق راخارج کرد .
چنین ترکیبی دارای سختی موقت است که می توان باحرارت دادن راجداکرد ولی اگراین یونهابه صورتی باشندکه به وسیلة حرارت دادن جدانشوندمی گوئیم ترکیب مادارای سختی دایم است . که می توان بااستفاده ازترکیباتی مثل ( کربنات سدیم ) یونهاراجداکرد .
سختی موقت + سختی دایم = سختی کل
موادموردنیاز :
1- متیل اورانژ 2- HCl
وسایل موردنیاز :
1- ارلن 2- بورت
- 1- شرح آزمایش :
درآزمایش اول برای اندازه گیری سختی موقت حدود100 cc آب شهر بر می داریم و 3 تا 4 قطره متیل اورانژ ( معرف ) به آن اضافه می کنیم وسپس به کمک 0.1 HCl نرمال آن راتیترمی کنیم . وقتی که رنگ زرد به نارنجی تبدیل شد به پایان تیترمی رسیم وحجم مصرفی اسید ( V ) را می نویسیم .
نرمالیتة اسید * حجم اسیدمصرفی = سختی موقت a = V x N
دراین مرحله 3.5 cc اسیدمصرف می شود .
a = 3.5 x 0.1 = 0.35 سختی موقت
قسمت دوم : تعیین سختی داتم
موادموردنیاز : 1- کربنات سدیم 2 -آب HCl -3
وسایل موردنیاز : 1- شعله 2- کاغذصافی 3- ارلن
شرح آزمایش : 1000 cc آب شهررابرداشته و 20 cc کربنات سدیم 0.1 نرمال به آن اضافه می کنیم . اجازه می دهیم که تمام آب بخارشده و فقط رسوب باقی بماندپس ازآن که تمام آب بخارشد 20 cc آب مقطر اضافه می کنیم وخوب هم می زنیم وسپس محلول رااضافه می کنیم . وقتی که محلول راصاف کردیم محلول زیر صافی را با استفاده از 0.1 HCl نرمال تیترمی کنیم حجم مصرفی اسیددراین مرحله است .
برابر 15.9 میلی لیتر
قسمت سوم :
درمرحلة سوم 20 cc کربنات سدیم 0.1 نرمال رابرداشته به کمک 0.1 HCl نرمال آن راتیترمی کنیم . ( البته قبل ازآن چندقطره متیل اورانژبه آن اضافه می کنیم ) . حجم مصرفی اسیددراین مرحله است . =11میلی لیتر
b=(15.9 - 11 ) 0.1 = 0.49 سختی دایم
سختی کل =420 gr/lit سختی کل
نتیجه گیری :
خواص فیزیکی وشیمیائی آب مانندشفافیت ، رنگ ، بو ، دما ،نمک های محلول درآن ، سختی خواص کاهشی و PH ، کیفیت آب رابیان می کند . دراین میان نمک های محلول درآب یکی ازمهمترین عوامل است . تمام نمک هایی که در آب محلول اند نشان دهندة ناخالصی های آب معدنی اند .
مهمترین عامل ازخواص آب سختی آن است . درجة سختی آب عبارت است ازتعدادمیلی اکی والان گرم های یون های کلسیم ومنیزیم دریک دسی مترمکعب آب . مقدار یون کلسیم و یون منیزیم راواحدسختی آب انتخاب می کنند .
به طورکلی سه نوع سختی وجوددارد : 1- سختی موقت 2- سختی دایم 3-سختی کل
سختی موقت : این سختی به دلیل وجودبی کربناتهای کلسیم ومنیزیم است که دراثرجوشیدن به کربناتهای نامحلول تبدیل می شوندوبه صورت جامدته نشین می گردند .
- 2- سختی دایمی : این سختی شامل آن دسته ازنمک های کلسیم ومنیزیم است که دراثرجوشیدن آب به صورت محلول باقی می مانند .
- 3- سختی کل : مجموع سختی های دایمی و موقتی راسختی کل می گویند . آبی راکه هرکیلوگرم آن کمترازیک گرم نمک داشته باشد آب شیرین می گویند وآبی راکه درهرکیلوگرم آن بیش از یک گرم نمک وجودداشته باشدآب شورمی گویند . آبی که درهر آن کمتراز3 میلی گرم اکی والان گرم نمک های وجودداشته باشدآب نرم می گویند . آبی که درهردسی مترمکعب آن بیش از 3 میلی اکی والان گرم نمک های وجودداشته باشدراآب نیم سخت گویند . وآبی که درهر ازآن 4 تا 10 میلی گرم اکی والان گرم موجودباشد راآب سخت می گویند .
کتاب آزمایشهای شیمی عمومی refrence :112 تا 115 : صفحه محمدرزمجو : تألیف
فرمول شیمیایی مایع سفید کننده یا همان آب ژاول که برای سفید کردن پارچه و شستشوی دیواره های حمام، توالت و .... بکار میرود، NaOH+NaCl+H2O است و از ترکیب کردن گاز کلر با سود سوزآور در غلظتهای 5 الی 10 درصد کلر فعال به بازار عرضه میشود.
تولید به روش تزریق گاز کلر:
Cl2 + NaOH NaClO + NaCl + H2O
همانطور که از واکنش بالا پیداست، چنانچه گاز کلر را در محلول سود سوزآور وارد کنید، آب ژاول تولید میشود. تمامی مخازن و لوله های داخل آن که برای تولید مایع سفید کننده بکار میروند باید از جنس PVC باشند، زیرا گاز کلر در مجاورت با رطوبت با هر فلزی ترکیب میشود.
در داخل مخزن سود را میریزند و از پایین گاز کلر را وارد میکنند. میل ترکیبی گاز کلر با سود بسیار زیاد است، به همین دلیل گاز کلر در خلال زمانی که از ته مخزن به سطح مخزن میرسد، جذب میشود.
در اینجاست که هرچه خروجی گاز کلر از سطح مخزن کمتر باشد نشاندهنده این است که واکنش دارد بخوبی صورت می گیرد.
آنچه در رابطه با تهیه آب ژاول به روش فوق اهمیت دارد، دقت در کنترل، به هنگام تولید آن است زیرا چنانچه تزریق کلر قبل از خاتمه عمل متوقف نشود، واکنش برعکس شده و بسرعت دما بالا میرود و محصول از بین میرود.
اگر pH به حدود 2/12-12 برسد واکنش پایان یافته است. از آنجائیکه هرچه محیط سردتر باشد واکنش نیز بهتر صورت میگیرد بایستی دقت شود تا دما از 42 درجه سانتیگراد بالاتر نرود. در یک تولید نرمال، گاز کلر از حدود 20 درجه شروع شده و در دمای 42 درجه پایان میگیرد.
حلالیت عبارت است ازمقداری ازیک جسم برحسب گرم که دردمای معین درصدگرم حلال ، حل شده وتولید محلول سیرشده ای حل کندولی آنچه که بیشترمتداول است قابلیت حل شدن است که برای یک ماده برابراست با مولاریتة آن .
ماده از ذرات کوچکی به نام مولکول تشکیل یافته است که دارای حرکات انتقالی - ارتعاشی وچرخشی است . مولکولهاهمدیگررامی ربایند درواقع بین آنها نیروهای جاذبه ودافعه وجوددارد .
درموردگازهابایدتوجه داشت که این نیروهاصفراست . درحالت مایع نیروهای جاذبه بین مولکولی نسبتاًضعیف ترازحالت جامدبوده وفاصلة بین مولکولها بیشترودرنتیجه تااندازه ای ازیکدیگردورند ، به طوری که آزادانه می توانند به تمام جهات حرکت کنند ، به همین دلیل مایعات شکل معینی ندارندوجامدات دارای حرکت ارتعاشی هستند . همچنین بین مولکولهای مایع فضای خالی وجوددارد که این فضادرجامدات کمتراست .
مراحل انحلال :
1 - تماس : بادرنظرگرفتن نظریة « ذره ای جنبشی » ماده می توان گفت که یک لایه ازمولکولها ، اتم هایایون های سطح خارجی ماده حل شونده بایک لایه ازمولکولهای حلال ، مجاورشده ودرنتیجه بین دوفازمادة حل شونده وحلال تماس حاصل می شود .
2- انحلال : دراین مرحله مولکولها ، اتم هایایون های دوماده که باهم درتماسند هرکدام ارتباط خودراباذره های همانندشان قطع می کنند ودرفضای مجاورسطح تماس ، مخلوطی شامل هردوذره به وجودمی آید . هرچه ذره های جامدریزترباشندسرعت انحلال بیشتراست زیراریزتربودن ذره های جامد سبب از دیادسطح خارجی آنها شده ، مقداربرخوردهای مؤثربامولکولهای حلال درواحدسطح بیشترمی شود .
3- پخش : پراکندگی ذره های حل شونده درون حلال تازمانی که بین قسمتهای مختلف محلول ، تفاوت غلظت وجوددارد همچنان ادامه پیدا می کند ولی به محض آنکه این تفاوت غلظت ازبین رفت درحرکت انتقالی ذره های حل شده تعادل به وجودمی آید . یعنی درتمام حجم محلول ، ذره های ماده حل شونده به طوریکنواخت پخش شده وجابجایی مولکولها مساوی است .
عوامل وفاکتورهای انحلال :
پدیدة انحلال به طبیعت وماهیت حلال وجسم حل شونده بستگی دارد ومهمترین عوامل آن عبارتند از :
- 1- بهم زدن : دراثربهم زدن پدیده های محلول غلیظ به اطراف پخش شده ولایه هایی ازحلال رابه جسم جامدنزدیک کرده وباعث انحلال آن می شود . ممکن است ضمن بهم زدن ، مادةحل شونده به ذره های کوچکترتبدیل شود .
- 2- دما : ازدیاد دماسبب ازدیاد جنبش مولکولی وسرعت مولکولهای حلال شده ودرنتیجه احتمال برخوردمولکول های حلال بامادة حل شونده درواحدحجم وزمان بیشترمی شود اماباید توجه داشت که انحلال گازهاباازدیاددماکاهش می یابد ولی ، لغزش فشارزیادمی شود .
- 3- سطح تماس : هرقدرذره هاریزترباشند تعدادذره های بیشتری از ماده جامددرواحدزمان موردحمله وهجوم مولکولهای حلال قرارگرفته وازشکل جامدخارج می شودوبه صورت محلول درمی آیند . اصولاً انحلال ازسطح جسم حل شونده شروع می شود . پس هرچه جسم ریزترباشدانحلال سریعتروبهترصورت می گیرد .
- 4- قراردادن مادةحل شونده درسطح حلال : محلولی که بدین طریق در سطح مایع تشکیل می شود ازمایع خالص سنگین تراست ولذابه سمت پائین می رودکه درصنعت کاربرددارد ، زیراسرعت حل شدن رازیادمی کند .
آزمایش اول
« آزمایش حلالیت »
موادموردنیاز : 1- ید 2-نفتالین 3- نمک طعام 4- آب 5- الکل
6-تتراکلریدکربن 7- کلروفرم
وسایل موردنیاز : 1- لولةآزمایش 2-پیپت
شرح آزمایش :
مرحلة اول : ابتدا 5cc آب ، الکل وتتراکلریدکربن برمی داریم . 0.5 گرم ید رابه این حلال اضافه می کنیم . تابررسی کنیم که یددرکدامیک بهتروسریعترحل می شود .
مشاهده می شود .
- - درآزمایش یدباآب مشاهده شدکه یددرآب حل نمی شودونتیجه گرفتیم که چون یدیک مادة غیرقطبی است درآب که قطبی است حل نمی شود .
- - درآزمایش یدباالکل مشاهده شدکه یددرالکل حل می شودچون هردوغیرقطبی اند .حلال حاصل به رنگ قرمزخونی درمی آید .
- - درآزمایش یدباتتراکلریدکربن نیزمشاهده شدکه درهم حل می شوند . چون هردوغیرقطبی اند . حلال حاصل به رنگ بنفش است .
مرحلة دوم : اضافه کردن نمک به آب ، الکل ، تتراکلریدکربن
- - درآزمایش نمک باآب مشاهده شدکه درهم حل می شوندچون هردو قطبی اند . درضمن به این دلیل است که پیوندمولکولی آب ازنوع هیدروژنی است ونمک ترکیبی یونی است .
- - درآزمایش نمک باالکل مشاهده شدکه نمک به مقدارکم درالکل حل شدواین به دلیل قطبیت ضعیف الکل است .
- - درآزمایش نمک ، تتراکلریدکربن مشاهده شدکه درهم حل نمی شوند چون نمک یک ترکیب یونی است حال آنکه تتراکلریدکربن غیرقطبی است. درضمن جاذبه های تتراکلریدکربن ازنوع ضعیف لاندن می باشد .
مرحلة سوم : اضافه کردن نفتالین به آب - الکل - تتراکلریدکربن .
- - درآزمایش نفتالین باآب مشاهده شدکه نفتالین درآب حل نمی شودچون نفتالین یک مادة غیرقطبی است . حال آنکه آب قطبی است .
- - درآزمایش نفتالین باالکل مشاهده شدکه نفتالین درالکل حل نمی شود زیراجاذبه های آنهاازیک نوع نیست . مایع یاحلال بدست آمده زردرنگ است .
- - درآزمایش نفتالین باتتراکلریدکربن مشاهده شدکه درهم حل می شوند چون که هردوغیرقطبی اند .
مرحلة چهارم : اضافه کردن کلروفرم به آب ، الکل ، تتراکلریدکربن
- - درآزمایش کلروفرم باآب مشاهده شدکه کلروفرم درآب حل نمی شود چون کلروفرم قطبیت ضعیفی دارد .
- - درآزمایش کلروفرم باالکل مشاهده شدکه درهم حل می شوندچون که هردوغیرقطبی اند .
- - درآزمایش کلروفرم باتتراکلریدمشاهده شدکه درهرهم حل می شوند چون که هردوغیرقطبی اند . ( البته کلروفرم %100غیرقطبی نیست . درواقع قطبیت ضعیفی دارد)
حلال | حل شونده | |||
حلال | ید | نمک طعام | نفتالین | کلروفرم |
آب | حل نمی شود | حل می شود | حل نمی شود | حل نمی شود |
الکل | حل می شود | به مقدارکم حل میشود | به مقدارخیلی کم حل میشود | حل می شود |
تتراکلریدکربن | حل می شود | حل نمی شود | حل می شود | حل می شود |
نتیجه گیری :
مولکول های کواوالانسی قطبی درآب یاحلال های قطبی دیگرحل می شوند . که علت این حل شدن یکی پیوندهیدروژنی است ودیگری لغزایش میزان بی نظمی .
درحقیقت نیروی دوقطبی - دوقطبی داتمی برهرماده عامل اصلی جداشدن مولکولهای کواوالانسی درآب ویادرهمدیگراست . زیراآب می تواندبا الکلها ،آلدهیدهاوکتونهامجتمع شود . به طورکلی الکلهاوموادی که OH دارنددرآب حل می شوند .
درانحلال Nacl درآب مولکولهای قطبی آب تدریجاً اطراف مولکول قطبی Nacl قرارمی گیرندتاآنرا به یون های یونیزه کنند . یونهای حاصل با تعدادی از مولکولهای آب پیوند برقرار می کنندیعنی هیدراته شدن یونها رخ می دهد . به عنوان مثال درانحلال یددرآب علت اینکه یددرآب حل نشد آن ست که پیوندهای هیدروژنی که بین مولکول های آب برقراراست قوی ترازجاذبه ای است که ممکن است بین مولکول های آب و یدبرقرارباشد . به عبارت دیگر نیروهای جاذبة قابل توجهی بین مولکول های یدوآب برقرار نمی شود . بلکه نیروهای دافعه به وجودآمده دمادوفازخواهیم داشت .
کتاب آزمایشهای شیمی عمومی refrence :112 تا 115 : صفحه محمدرزمجو : تألیف
آنالیز و شناسایی آمونیاک:(NH3)
آمونیاک میتواند به آسانی از طریق بوی آن شناخته شود و مقدار آن با تیتراسیون قابل اندازه گیری است. آمونیاک در مقدار اضافی محلول استاندارد سولفوریک اسید رقیق جذب میشود و مقدار باقیمانده اسید در طی یک تیتراسیون برگشتی با سود سوز آور استاندارد و شناساگر متیل اورانژ تیتر میگردد.
همچنین میتوان از تیتراسیون پتانسیومتری نیز برای تعیین نقطه پایانی استفاده کرد. غلظتهای بسیار کم آمونیاک در فاضلاب، آبهای زیرزمینی، آبهای آشامیدنی و هوا را میتوان بوسیله تکنیکهای گوناگون رنگ سنجی یا به کمک الکترود انتخابگر آمونیاک تعیین کرد. آمونیاک با معرف نسلر در شرایط قلیائی واکنش داده و رنگ آن زرد میشود. شدت رنگ با اسپکتروفوتومتر، اندازه گیری میشود. مقدار جذب بستگی به مقدار آمونیاک دارد.
در دیگر حالت آمونیاک میتواند توسط روش یدو فنل آبی شناسایی شود. در این روش آمونیاک با هیپوکلریت واکنش دهد و مونوکلرآمین ایجاد میکند که این ترکیب با فنل در حضور کاتالیزور سولفات منگنز واکنش داده و یدوفنل آبی را ایجاد میکند.
اندازگیری اهن در سنگ معدن با روش تیتراسیونهای پتانسیومتری ( تیتراسیونهای ردوکس )
محلول های مورد نیاز
تیترکننده : محلول سریک امونیوم نیترات
طرز تهیه : 5.48 گرم از نمونه خالص و جامد Ce(NH4)(NO3)6 را در یک بالون 100 میلی لیتری با اسید سولفوریک یک مولار به حجم برسانید. می توانید به جای تهیه این محلول از پرمنگنات پتاسیم استاندارد ( 1.88 گرم در یک لیتر اب مقطر ) استفاده کنید

یونولیت یا پلیاستیرن (Polystyrene) که در ایران با نام تجاری پلاستوفوم هم شناخته میشود، نوعی پلیمر سفید رنگ و عایق رطوبت و صدا و حرارت است که از فرایندهای پتروشیمی تهیه میشود. این ماده اولین بار توسط آلمان نازی در جنگ جهانی دوم برای ساخت پلهای شناور روی آب ساخته شد....
عمل هیدرولیز چربی یا روغن را اصطلاحا صابونی کردن مینامند. برای این کار، چربی (a) را با محلول سود حرارت میدهند. در نتیجه گلیسرین (b) و مخلوطی از نمک سدیم اسیدهای چرب (c) مطابق واکنش زیر حاصل میشود:
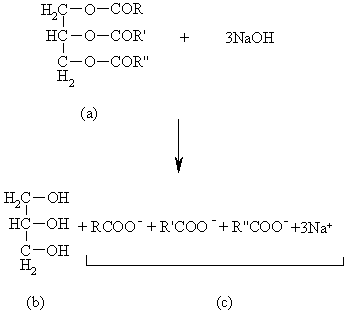
چربیها و روغنهای طبیعی استر اسیدهای آلیفاتیک یک ظرفیتی با تعداد اتمهای کربن زوج و گلیسرین میباشند که آنها را گلیسرید نیز مینامند. چربیها و روغنها به طور کلی دارای ساختمان (a) میباشند. چربیها جامد و روغنها مایع میباشند. نقطه ذوب چربیها بالاتر از نقطه ذوب روغنها است. این اختلاف بستگی به نوع و مقدار اسید مربوطه دارد. هرچه مقدار اسیدهای اشباع نشده در ساختمان یک چربی بیشتر باشد، نقطه ذوب پایین تری دارد. اگر چربی تنها از اسیدهای اشباع شده تشکیل شده باشد مانند پیه گوسفند و غیره نقطه ذوب بالا خواهد داشت.
روغنهای نباتی مانند روغن زیتون، خرما، نارگیل و کرچک علاوه بر این که دارای اسیدهای چرب (اولئیک، استئاریک و پالمیتیک) هستند، اسیدهای اشباع نشده با چند پیوند دوگانه مانند اسید لینولئیک به فرمول زیر نیز در ساختمان آنها شرکت میکنند.
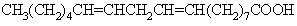
مکانیزم عمل هیدرولیز استر را در محیط بازی میتوان به صورت زیر نوشت:
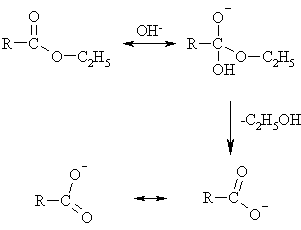
ابتدا یون هیدروکسید به عنوان نوکلئوفیل (هسته دوست) به کربن گروه کربنیل حمله کرده، پس از خارج شدن یک مولکول الکل، انیون اسید به صورت هیبرید رزونانس فوق، پایدار میگردد.
50 گرم چربی را در یک بشر 250 میلی لیتری ریخته و به طور ملایم آنرا حرارت دهید تا ذوب شود (دما نباید از 70 درجه بالاتر برود).
در حالیکه چربی را حرارت میدهید ضمن به همزدن مداوم محلول سود (7گرم در 50 میلی لیتر آب) را در قسمتهای 5 میلی لیتر به چربی اضافه کنید. پس از افزودن اولین 5 میلی لیتر سود، زمان اضافه نمودن 5 میلی لیتر بعدی وقتی است که سود اضافه شده قبلی تقریبا مصرف شده باشد. (برای اطمینان از مصرف سود نوک اسپاتول را در بشر فرو برده و یک قطره معرف فنل فتالئین روی آن بچکانید، چنانچه رنگ آن فورا ارغوانی شد دلیل آن است که هنوز سود در محیط وجود دارد و باید به هم زدن را ادامه داد).
پس از افزودن آخرین قسمت سود، آنقدر به هم بزنید تا صابون یک حالت کشدار به خود بگیرد (بوی صابون در این حالت به خوبی استشمام میشود.) صابون حاصل را در قالب ریخته و بگذارید یک هفته بماند تا عمل صابونی شدن کامل شود. صابون حاصل دارای مقدار زیادی گلیسیرین است، چنانچه بخواهند گلیسیرین آنرا جدا کنند، قبل از ریختن در قالب، صابون را به مدت 24 ساعت در محلول اشباع شده نمک طعام قرار میدهند، سپس قرص صابون را از درون ظرف خارج کرده و پس از شستن به قطعات کوچک تقسیم نموده، در هوا خشک میکنند.
روش دیگر تهیه صابون
در یک بالن، cc50 روغن مایع را با cc40 اتانول و gr3 پتاسیم هیدروکسید ریخته و بمدت نیم ساعت رفلاکس کنید. پس از اتمام این مدت چند قطره از مخلوط را در مقدار کمی آب حل کنید که اگر قطره روغنی روی آب قرار نگرفت واکنش پایان یافته و اگر روغن در سطح آب مشاهده شد عمل رفلاکس را به مدت 15 دقیقه دیگر ادامه دهید. سپس الکل موجود در مخلوط را به وسیله تقطیر ساده جدا کنید و ماده باقیمانده در بالن را در cc 75 آب مقطر گرم حل کنید. دقت کنید که حتما الکل موجود در بالن از مخلوط خارج شود سپس آزمایش زیر را انجام دهید.
الف) مقدار 25 میلی لیتر محلول به دست آمده را به 25 میلی لیتر آب نمک اشباع به آهستگی اضافه کنید مخلوط را صاف کرده و ماده جامد که صابون میباشد روی کاغذ صافی میماند. آنرا با آب نمک اشباع بشوئید و صابون را در روی یک ظرف شیشه ای پهن کنید.
ب) مقدار 10 میلی لیتر آب شهر را با 10 میلی لیتر محلول صابون مخلوط کرده تکان دهید و نتیجه را گزارش کنید.
عناوین یادداشتهای وبلاگ
